
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目: 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化合物X、Y的说法不正确的是( )
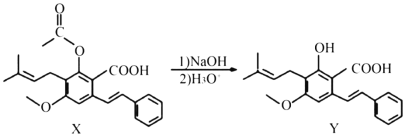
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某烷烃和单烯烃的混合气体2.24L,将其完全燃烧,产生的气体缓缓通过浓硫酸,浓硫酸增重4.05克,将剩余气体通入碱石灰,碱石灰质量增加了6.60克,另取该混合气体2.24L通过过量溴水,溴水质量增加了1.05克。
(1)混合气体由哪两种烃组成____?
(2)两种烃的体积分数各是多少______?
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO![]() +3Cl+4H++H2O
+3Cl+4H++H2O
B.NaHCO3溶液中加少量Ba(OH)2溶液:HCO![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O![]() +2H+=SO2↑+S↓+H2O
+2H+=SO2↑+S↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO![]()
B.滴加KSCN溶液显红色的溶液中:NH![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.c(OH-)/c(H+)=10-12的溶液中:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:
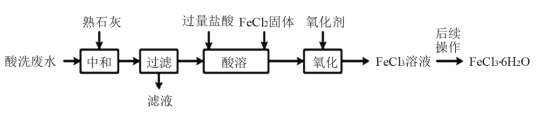
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 | 4.3 | 7.6 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 | 5.6 | 9.6 |
回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:1的原因是___________。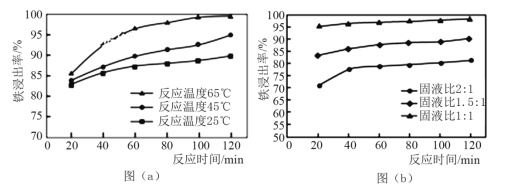
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为__________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为__________,电解总反应的离子方程式是 __________。
(5)将得到的FeCl3溶液在HCl气氛中______、______、过滤、洗涤、干燥得FeCl36H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com