
科目: 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.在饱和的偏铝酸钠溶液中不断通入CO2:
2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
B.在饱和的碳酸钠溶液中不断通入CO2
CO32—+2Na++CO2+H2O=2NaHCO3↓
C.在磷酸二氢钾溶液中加入过量的Ba(OH)2溶液;
2H2PO4—+3Ba2++4OH—=Ba3(PO4)2↓ +4H2O
D.在磷酸二氢钙溶液中加入过量的KOH溶液:
2H2PO4—+3Ca2++4OH—=Ca3(PO4)2 十4H2O
查看答案和解析>>
科目: 来源: 题型:

| 稀H2SO4 |
| △ |
| 一定条件 |
| 试剂X |
| NaOH溶液 |
| 一定条件下 |
| 一定条件下 |







查看答案和解析>>
科目: 来源: 题型:阅读理解

| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 光合 |
| 作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |

查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
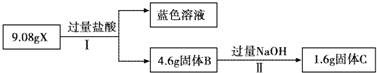
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com