
科目: 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】反应O2(g)+2SO2(g)2SO3(g) ΔH<0,若在恒容绝热容器中发生,下列选项表明该反应一定已达平衡状态的是
A.容器内的密度不再变化
B.容器内的温度不再变化
C.容器内气体的反应速率υ正(O2)=2υ逆(SO2)
D.容器内气体的浓度c(O2)∶c(SO2)∶c(SO3)=1∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组设计实验制取氨气并探究氨气的有关性质:
(1)实验室制备氨气,下列方法中适宜选用的是 ___________(填编号)
A . 氯化铵溶液与氢氧化钠溶液共热
B. 固体氢氧化钠中滴加浓氨水
C. 固态氯化铵加热分解
D. 固态硝酸铵加热分解
E. 固态氯化铵与熟石灰混合加热
(2)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图:
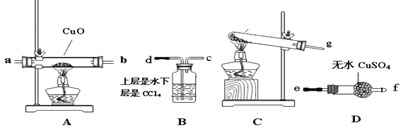
①装置C中发生反应的化学方程式为______________
②根据上述提供的装置正确的连接顺序为____________(用各接口序号表示)
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________。
(3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________。已知:Cu2O+2H+=Cu+Cu2+ +H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:
实验1:准确称取Wg草酸晶体配成100ml水溶液;
实验2:用浓度为0.100molL-1KMnO4溶液滴定所配制的草酸溶液,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)实验1中,配制100ml草酸水溶液所需要的一组仪器是________(填相应编号)
A、0.001g的电子天平 B、50ml酸式滴定管 C、100ml量筒 D、100ml容量瓶 E、烧杯 F、胶头滴管 G、锥形瓶
(2)实验2中H2C2O4·xH2O中x值的测定是利用氧化还原反应滴定法
①其中正确操作步骤的顺序为___________
a.用移液管取用25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸。
b.把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c.取KMnO4标准液注入滴定管中至“0”刻度以上
d.调节液面至“0”或“0”刻度以下,记下读数
e.把标准KMnO4溶液润洗滴定管2~3次
f.把锥形瓶放在滴定管下面,用KMnO4标准液滴定至终点并记下滴定管的读数
②下列关于滴定分析,正确的是________________。
A. 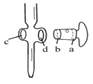 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
C. 将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D. 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E. 滴定到终点时俯视读取数据,测得的x值偏大
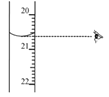
③图中滴定终点时显示的读数为_______ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F( )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
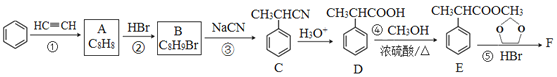
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。(无机试剂任选)
的合成路线_________________。(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为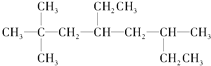 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 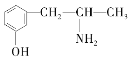 B.
B. ![]() C.
C. 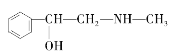 D.
D. 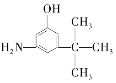 E.
E. 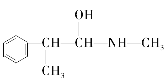
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
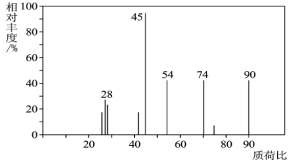
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
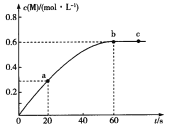
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目: 来源: 题型:
【题目】用氨气制取尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ΔH<0
(1)该反应能自自发进行的条件是___________
(2)反应在恒容密闭容器中达到平衡时,下列说法不正确的是________
A.加入催化剂,平衡常数不变
B.容器内的压强不再变化
C.容器内的气体密度不再变化
D.降低温度,平衡向正反应方向移动
(3)某温度下,向容积为10L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。
①该段时间内用NH3表示的平均反应速率为___________
②该温度下此反应平衡常数K的值为________。
③图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若在25s时保持其它条件不变情况下使用催化剂,使反应延续至70s,请在图中用实线画出25~70s内该反应的进程曲线__________。
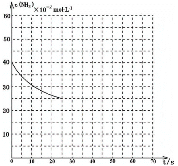
(4)尿素在水溶液中会分解,某研究小组分别用三份不同初始浓度的尿素溶液测定分解反应速率,得到c(CO(NH2)2)随时间变化趋势如图所示:
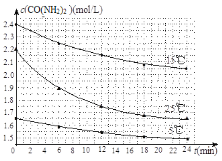
根据图中信息,如何说明分解反应速率随温度升高而增大__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年。已知在元素周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。W与Q可以形成一种高温结构陶瓷材料,W的氯化物分子呈正四面体结构。回答下列问题:
(1)元素X在元素周期表中的位置_________
(2)W的氧化物的晶体类型是____________
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________
(4)这5个元素的氢化物分子中:
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______
②电子总数相同的氢化物的化学式和立体结构分别是_________
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com