
科目: 来源: 题型:
【题目】实验室用有机含碘![]() 主要以
主要以![]() 和
和![]() 的形式存在
的形式存在![]() 废水制备单质碘的实验流程如下:
废水制备单质碘的实验流程如下:
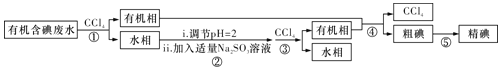
已知:Ⅰ![]() 碘的熔点为
碘的熔点为![]() ,但固态的碘可以不经过熔化直接升华;
,但固态的碘可以不经过熔化直接升华;
Ⅱ![]() 粗碘中含有少量的
粗碘中含有少量的![]() 杂质。
杂质。
下列说法正确的是( )
A.操作![]() 中发生反应的离子方程式为
中发生反应的离子方程式为![]()
B.操作![]() 和
和![]() 中的有机相从分液漏斗上端倒出
中的有机相从分液漏斗上端倒出
C.操作![]() 为过滤
为过滤
D.操作![]() 可用如图所示的水浴装置进行
可用如图所示的水浴装置进行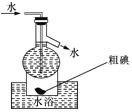
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下。
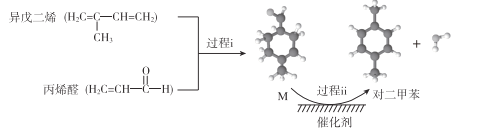
下列说法不正确的是
A. 过程i发生了加成反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D. 该合成路线理论上碳原子100%利用,最终得到的产物易分离
查看答案和解析>>
科目: 来源: 题型:
【题目】观察图中 A、B、C 三个装置,回答下列问题:
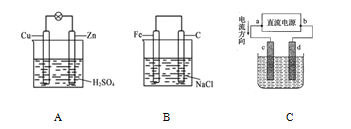
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一铜片,可观察到铜片上_________(填“有”或“没有”)气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为_______。
(2) 如果烧杯中最初装入的是 500 mL 2 mol·L-1 硫酸溶液,构成铜锌原电池,当收集到 11.2 L(标准状况下)H2 时,溶液体积变化忽略不计,则烧杯内溶液中硫酸的物质的量的浓度为_______mol/L。
(3) 如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图 B),放置数天后,铁片生锈。负极反应式为_______。
(4) 图 C 是电解 CuCl2 溶液的装置,其中 c、d 为石墨电极。
①正极为_______(填“a”或“b”)。
②阳极电极反应式为_______,检验该阳极产物的方法是将_______试纸靠近电极。
③电解一段时间后发现阴极增重 6.4 g,若该电解反应所需的电子全部由氢氧燃料电池提供,则至少需要消耗_______L 氢气(标准状况下)才能满足需要。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径:

(1) 氢气是一种________(选填“可再生”或“不可再生”)能源。上图中 4 个过程中能量转化形式有_______。
A 2 种 B 3 种 C 4 种 D 4 种以上
(2) 电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
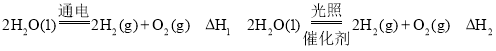
①以上反应的△H1_____△H2 (选填“>”、“<”或“=”)。
②电解水一段时间后,若阴极析出 224 mL(标准状况下)气体,则电路在通过的电子_____mol。
(3)已知 H2O(l)= H2O(g) △H= +44 kJ/mol,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式_____,若 4 g 氢气燃烧生成液态水时放出的热量是_____kJ。
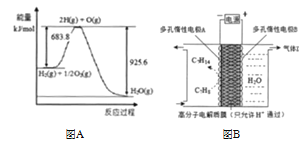
(4) 氢能利用需要选择合适的储氢材料。一定条件下,如图 B 所示装置可实现有机物的电化学储氢,总反应:2C7H8+ H2O(l)![]() 2C7H14 + 3O2(g)电解过程中产生的气体 X 为____。
2C7H14 + 3O2(g)电解过程中产生的气体 X 为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
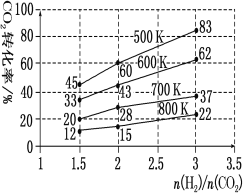
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
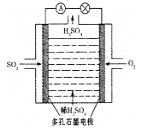
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚烷胺作为帕金森病的治疗药,于1998年被批准用于流感病毒A型感染性疾病的治疗,其合成路线如图所示。下列说法正确的是( )
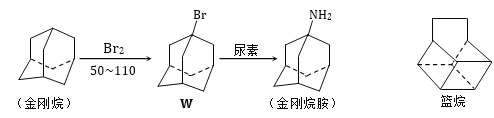
A.金刚烷能使溴水和酸性KMnO4溶液褪色
B.金刚烷胺能溶于稀盐酸
C.金刚烷与篮烷互为同分异构体
D.上述四种有机物中篮烷的沸点最高
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目: 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()
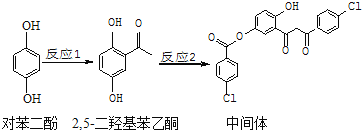
A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学反应方程式为
H2(g)+![]() O2(g)=H2O(l) △H1
O2(g)=H2O(l) △H1
C(s)+O2(g)=CO2(g) △H2
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H3
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
则△H4的正确表达式为
A. △H3-2△H1-2△H2B. 2△H1+2△H2-△H3
C. 2△H1-2△H2+△H3D. 2△H1-2△H2-△H3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是 ( )
A.在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
B.除去NaCl中少量的![]() ,可将固体混合物制成热饱和溶液,冷却结晶、过滤
,可将固体混合物制成热饱和溶液,冷却结晶、过滤
C.将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率
D.将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴![]() 溶液,不久铁钉周围出现蓝色沉淀
溶液,不久铁钉周围出现蓝色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com