
科目: 来源: 题型:
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 | 有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 | 将第一份滤液与稀盐酸混合 | 产生大量气泡 |
| 步骤3 | 将第二份滤液加热 | 溶液变浑浊,且有大量无色气体产生 |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目: 来源: 题型:
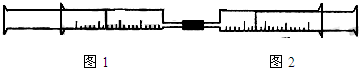
| 实验序号 | 图1针筒内物质 | 图2针筒内物质 | 图1针筒的现象 |
| 1 | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 10mL1mol/LAlCl3溶液 | 40mL1mol/LNaOH溶液 | 先有白色沉淀,后沉淀溶解 先有白色沉淀,后沉淀溶解 |
| 3 | 10mL紫色石蕊试液 | 25mLCl2 | 先变红后褪色 先变红后褪色 |
| 4 | 15mLCl2 | 40mLNH3 | 黄绿色变为无色 黄绿色变为无色 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com