
科目: 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
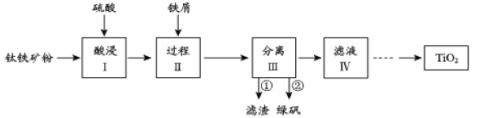
已知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式:_____________________。
(2)过程II中加入适量铁屑的目的是_____________________________。
(3)分离III中步骤②得到绿矾的操作是__________________________。
(4)由滤液IV提取TiO2的过程如下:
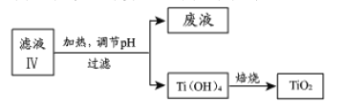
①请用化学平衡移动原理解释滤液加热煮沸的目的:_______________。
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于______℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -26.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 来源: 题型:
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.06g·L-1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
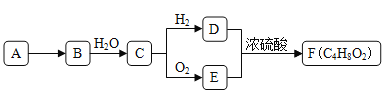
请回答:
(1)有机物D中含有的官能团名称是__________________。
(2) D+E→F的反应类型是_________________________。
(3)有机物A在高温下转化为B的化学方程式是_________________。
(4)下列说法正确的是___。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】水杨酸己酯分子式为C13H18O3,具有花果香味,用作化妆品香料的定香剂,也用作烟草香精。它的一种同分异构体A具有如下转化关系:
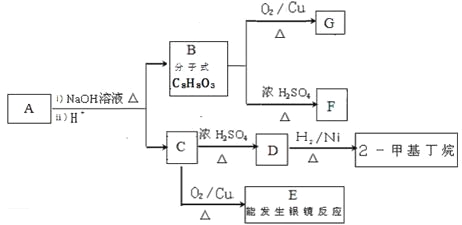
已知:
①C分子中有一个碳原子连接着4个不同的原子或原子团,且1 molC和足量金属Na反应能产生0.5 mol H2
②F中除了含有1个苯环外,还含有1个五元环
(1)写出B的结构简式___________________;写出G含有的官能团的名称_______________
(2)写出A和NaOH溶液反应的化学方程式_________________________________;
写出E发生银镜反应的化学方程式_______________________________________;
(3)B生成F的反应类型是________________;C生成D的反应类型是________________;
(4)化合物B有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式:
_______________________________________________
a.属于芳香族化合物
b.酸性条件下能发生水解反应且其中一种产物的苯环上的一氯代物只有两种
c.1 mol该有机物最多可消耗3molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
查看答案和解析>>
科目: 来源: 题型:
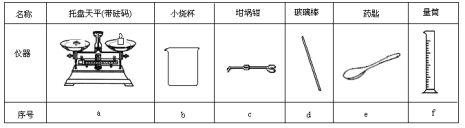
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
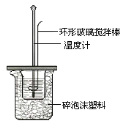
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如图:

(1)向沉淀池中通入CO2和氨气,应先通入___________(填化学式)。
(2)沉淀池中发生反应的化学方程式___________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是___________,加入细小食盐颗粒的作用是___________。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为___________(填化学式)。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________。
(5)侯氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中碳酸钠的纯度为:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】非诺贝特(fenofibrate)是降胆同醇及甘油三酯的药物,它的一条合成路线如下:
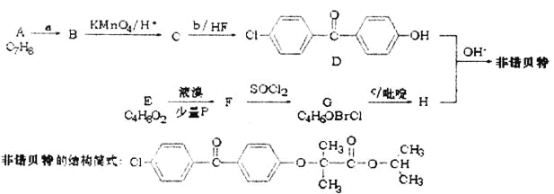
已知:①羧酸类有机物与液溴在少量磷作用下,发生![]() 取代。
取代。
![]()
(1)B的名称为_______________。
(2)C所含官能团的名称为___________。
(3)写出下列物质的结构简式b_____________,F__________________。
(4)写出G到H的反应方程式_______________。
(5)写出同时符合下列条件的D的同分异构体结构筒式____________。
①能发生银镜反应;②含5种不同环境氢的联苯酯类有机物。
1 mol该有机物最多消耗NaOH的物质的量为_______________。
(6)以2-甲基丙烯为原料制备E,设计合成路线(其他试剂任选)。
___________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是几种有机化合物的转换关系:
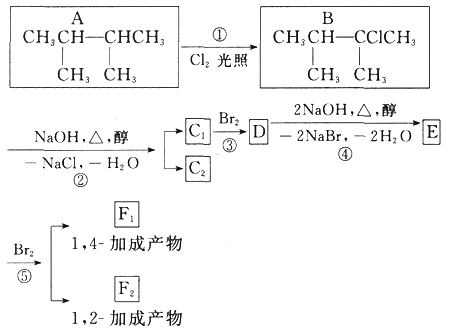
请回答下列问题:
(1)根据系统命名法,化合物A的名称是_____。
(2)上图反应中(填反应类型),①是_____反应,③是_____反应。
(3)E是重要的化工原料,写出由D生成E的化学方程式:_____。
(4)C1的结构简式是_____。
(5)写出符合下列条件的A的同分异构体的结构简式_____。
①含支链 ②核磁共振氢谱有3个峰
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为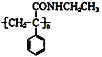 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com