
科目: 来源: 题型:
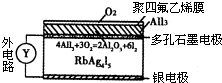 固体离子导体依靠离子迁移传导电流,Ag+离子可以在RbAg4I5晶体中迁移.下图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+离子可以在RbAg4I5晶体中迁移.下图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法中错误的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:阅读理解
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| (1) | 制氧气 | H2O2→O2 | C C |
| (2) | 制氨气 | NH4Cl→NH3 | B B |
| (3) | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com