
科目: 来源: 题型:
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是

A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
Ⅰ.在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___________________。
Ⅱ.乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g)ΔH=-484kJ/mol
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=________;相同温度下,该反应的化学平衡常数K=____________(用含K1、K2的代数式表示)。
Ⅲ. 甲醇的合成。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
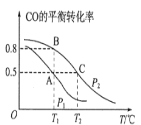
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________。
③下列叙述能说明上述反应能达到化学平衡状态的是______________(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=______,再加入1.0molCO后重新到达平衡,则CO的转化率______(填“增大,不变,减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制乙酸乙酯的主要装置如图所示:
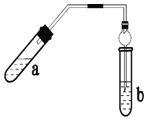
主要步骤:
①在 a 试管中 按 2:3:2 的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按 A 图连接装置,使产生的蒸气经导管通到 b 试管所盛的饱和碳酸钠溶液中;
③小火加热 a 试管中 的混合液;
④等 b 试管中收集到约 2mL 产物时停止加热。撤下 b 试管并用力振 荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
⑴实验室配制混合物加入试剂顺序:______。
⑵步骤![]() 中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
⑶A 装置中使用球形干燥管除起到冷凝作用外,另一重要作用是______,步骤![]() 中分离乙 酸乙酯必须使用的一种仪器是______。
中分离乙 酸乙酯必须使用的一种仪器是______。
⑷为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图 A 所示装置进行了以下 4 个实验。实验开始先用酒精灯微热 3min,再加热使之微微沸腾 3min。实验结束后充分振荡小试管 b 再测 有机层的厚度,实验记录如下:
实验编号 | 试管 a 中试剂 | 试管 b 中试剂 | 测得有机层的厚度/cm |
W | 3mL 乙醇、2mL 乙酸、2mL 18mol/L 浓硫酸 | 饱和 Na2CO3 溶液 | 5.0 |
X | 3mL 乙醇、2mL 乙酸 | 0.1 | |
Y | 3mL 乙醇、2mL 乙酸、2mL3mol/LH2SO4 | 1.2 | |
Z | 3mL 乙醇、2mL 乙酸、盐酸 | 1.2 |
①实验 Y 的目的是与实验 Z 相对照,证明H+ 对酯化反应具有催化作用。实验 Z 中应加入盐酸的体积 和浓度分别是______mL 和______mol/L
②分析实验______![]() 填实验编号
填实验编号![]() 的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为______![]() 填字母
填字母![]() 。
。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH 固体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
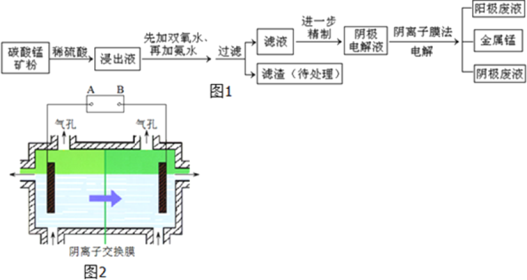
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
查看答案和解析>>
科目: 来源: 题型:
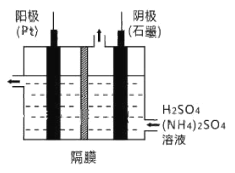
【题目】过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
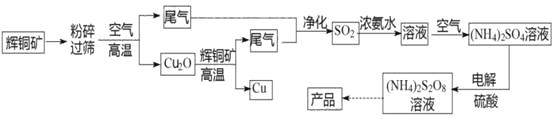
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式_______(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式_________;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①已知25℃,10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
则反应2SO2(g)+O2(g)![]() 2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为______mol,此反应的化学方程式是___________________________。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:V2+-e一=V3+。
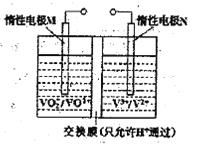
①电池放电时的总反应方程式为____________。充电时,电极M应接电源的____________极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)______(填“增大”、“不变”或“减小”),阳极的电极反应式为:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目: 来源: 题型:
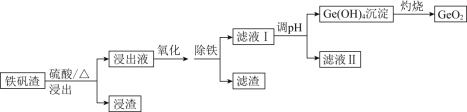
【题目】二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
离子 | Fe3+ | Mn2+ | Ge4+ |
开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
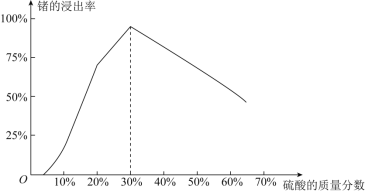
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________,浸渣的主要成分为________________(填化学式)。
(2)“氧化”时,可选用的试剂为________(填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com