
科目: 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 实验目的 | 分离方法 | 原理 |
A | 除去CO2中的HCl | 通入饱和Na2CO3溶液 | HCl和Na2CO3溶液反应生成CO2 |
B | 除去乙醇中少量的乙酸 | 加入足量生石灰蒸馏 | 乙醇和乙酸钙的沸点相差较大 |
C | 除去KNO3固体中NaCl | 冷却热饱和溶液重结晶 | NaCl在水中的溶解度很大 |
D | 分离乙酸乙酯和乙醇 | 用分液漏斗分液 | 乙醇乙酯和乙醇的密度不同 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
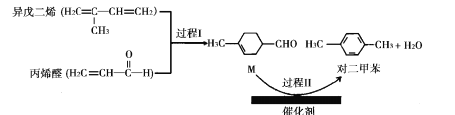
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质分离提纯(括号内的物质为杂质)的方法错误的是( )
A.乙醇(水)--加入CaO蒸馏
B.NaCl(KNO3)--结晶和重结晶
C.乙酸乙酯(乙醇、乙酸)--饱和碳酸钠溶液,分液
D.己烷(己烯)--溴水,分液
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
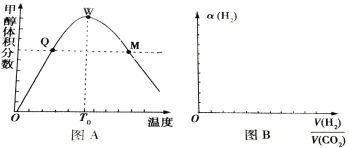
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化台物,物质之间存在如右下图所示的关系。下列说法不正确的是

A. YX2遇到蓝色石蕊试液先变红后褪色 B. 离子半径大小关系:Y>Z>X>W
C. 简单阴离子的还原性:Y>Z D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目: 来源: 题型:
【题目】消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
Ⅰ.含氯消毒剂在生产生活中有极其重要的作用。
(1)Cl2常用于自来水的杀菌消毒。Cl2溶于水后,溶液中具有氧化作用的含氯微粒除Cl2外还有______________。
(2)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质。其原因:一是_________________________________ (用离子方程式和相应的文字解释),二是生成的Fe(OH)3胶体具有较强的吸附 性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(3)KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。常用作消毒剂,其变化可以表示为:2KClO3+4HCl(浓) = 2KCl+2ClO2↑+Cl2↑+2H2O,若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:_______________________。
Ⅱ.铁的化合物高铁酸钠(Na2FeO4)是一种新型净水剂。
(1)高铁酸钠主要通过反应制取:2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O,则X的化学式为_____________。
(2)高铁酸钠在水中可以发生反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
Ⅲ.(1)H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。H2O2被称为“绿色氧化剂”的理由是________________________________。
(2)取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①加适量H2O2,紫红色褪去,并有气泡产生;
②加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③后通入足量SO2,发生反应:5SO2+2MnO4-+5Pb2++2H2O==5PbSO4↓+2Mn2++4H+。
则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸氯喹(结构如图所示)可用于治疗新冠肺炎,临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。2020年3月4日印发的《新型冠状病毒肺炎诊疗方案(试行第七》版中)明确规定了其用量。磷酸氯喹的结构如图所示,下列关于磷酸氯喹的说法错误的是
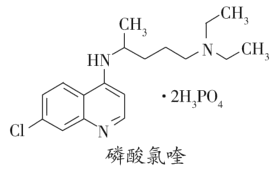
A.化学式为C18H33ClN3O8P2
B.1mol磷酸氯喹能与5molH2发生加成反应
C.分子中的—C1被—OH取代后的产物能与溴水作用
D.可以发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是
A. 所得溶液中c(NO3-)=2.75 mol·L-1
B. 所得溶液中c(Fe2+):c(Fe3+)=1:2
C. 反应后生成NO的体积为33.6 L(标准状况下)
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某100 mL溶液可能含有Na+、NH4+、Ca2+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出):
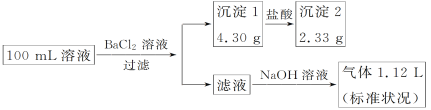
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Ca2+
B.若原溶液中不存在Na+,则c(Cl-)<0.1 mol·L-1
C.原溶液中c(Cl-)≥0.1 mol·L-1
D.原溶液一定存在Cl-,可能存在Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com