
科目: 来源: 题型:
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
| FeO | Fe2O3 | CaO | |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| △ |
| △ |
| 醇 |
| 醇 |




查看答案和解析>>
科目: 来源: 题型:
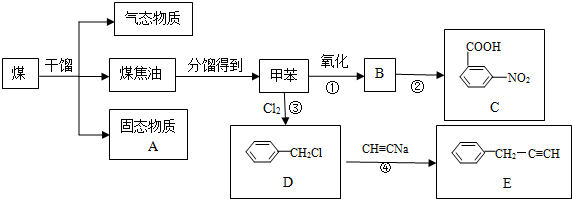

查看答案和解析>>
科目: 来源: 题型:阅读理解
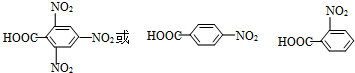
查看答案和解析>>
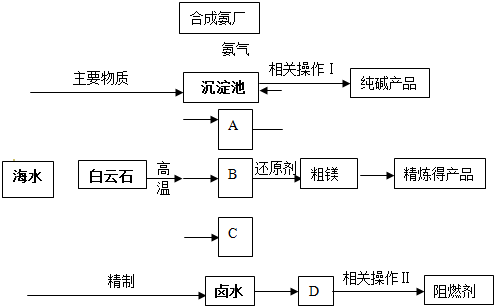
科目: 来源: 题型:阅读理解
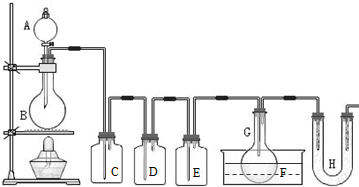 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
| N2+O2?2NO | N2+3H2?2NH3 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| K | 3.84×10-31 | 0.1 | 5×108 | 200 |

查看答案和解析>>
科目: 来源: 题型:
 (2011?静安区模拟)已知溶液中:还原性HSO3>I-,氧化性IO
(2011?静安区模拟)已知溶液中:还原性HSO3>I-,氧化性IO- 3 |
查看答案和解析>>
科目: 来源: 题型:
| A | D | |||
| E | G | M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com