
科目: 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】用甲苯生产一种常用的化妆品防霉剂,其生产过程如图所示(反应条件没有全部注明)。
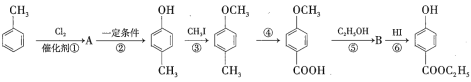
回答下列问题。
(1)有机物A的结构简式为___________________。
(2)在合成路线中,设计第③步反应的目的是________________________。
(3)写出反应⑤的化学方程式:_____________________________。
(4)请写出由![]() 生成
生成![]() 的化学反应方程式:_____________。
的化学反应方程式:_____________。
(5)下列有关说法正确的有____________(填序号)。

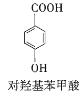
a.莽草酸、对羟基苯甲酸都属于芳香化合物
b.![]() 莽草酸与
莽草酸与![]() 溶液反应,最多消耗
溶液反应,最多消耗![]()
c.二者均可以发生酯化、加成等反应
d.利用![]() 溶液可区别莽草酸和对羟基苯甲酸
溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的 的所有同分异构体的结构简式:______。
的所有同分异构体的结构简式:______。
a.含苯环
b.可与![]() 溶液发生显色反应
溶液发生显色反应
c.一氯代物有两种
d.能发生银镜反应,不能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
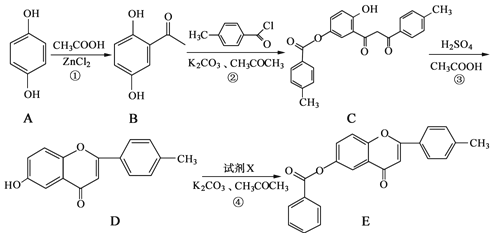
(1)化合物B中的含氧官能团的名称为_____和______。
(2)A→B的反应类型为___________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:__________。
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②分子中有4种不同化学环境的氢。
(5)已知 请写出以
请写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为__________________________。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:

序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是______对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究_________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。

已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
物质 | 颜色 | 熔点/℃ | 沸点/℃ |
Sn | 银白色 | 232 | 2260 |
SnCl2 | 白色 | 247 | 652 |
SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A
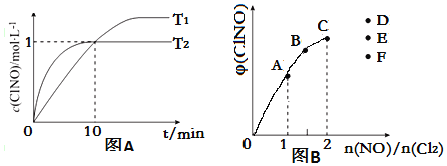
①温度为T1时,能作为该反应达到平衡的标志的有__________;
a 容器体积保持不变
b 容器压强保持不变
c 平衡常数K保持不变
d 气体颜色保持不变
e v(ClNO)= v(NO)
f NO与ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的__________点。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)![]() 2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
查看答案和解析>>
科目: 来源: 题型:
【题目】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。
(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。
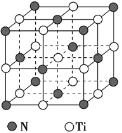
若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】75%的乙醇即医用酒精,因为杀灭病毒效果好且价格相对便宜,在生活中被大量使用。工业上主要用乙烯和水蒸气直接化合法制备乙醇。
回答下列问题:
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
则③C2H6(g)![]() C2H4(g) + H2(g) ΔH3=__________kJ/mol
C2H4(g) + H2(g) ΔH3=__________kJ/mol
(2)某温度下,一定量的乙烷在刚性容器内发生反应③,起始浓度为 c0,平衡时容器内总压强增加了 20%,乙烷的转化率为_____,该温度下反应的平衡常数 K=__用含 c0 的式子表示)。
(3)气相直接水合法制取乙醇的反应④:H2O(g)+C2H4(g)![]() CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)
CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)

①分析图像可知ΔH4_____0(填“>”或“<”),理由是_______。
②X 点,v正_________v逆(填“>””“<”或“=”)。在 X 点的条件下,进一步提高 C2H4 转化率的方法是_______(写一种)。
(4)乙醇可用于制备各种燃料电池。下图是乙醇碱性燃料电池的结构示意图,使用的离子交换膜是_____(填“阳离子”或“阴离子”)交换膜,a 侧的电极反应式是_______。
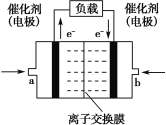
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com