
科目: 来源: 题型:
【题目】X、Y、Z三种物质直接的转化如图所示,其中不能一步实现的是( )
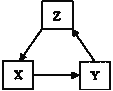
A | B | C | D | |
X | C | NaOH | CH3CH2OH | N2 |
Y | CO | Na2CO3 | CH3CHO | NH3 |
Z | CO2 | NaHCO3 | CH3COOH | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转变如图所示,(吸附在催化剂表面的用“·”表示)下列说法错误的是( )
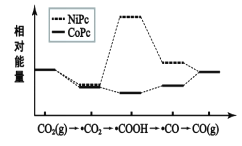
A.使用催化剂NiPc需要的条件更高
B.·COOH经过还原反应得到CO
C.反应过程中存在极性键的断裂和生成
D.相同微粒吸附在不同的催化剂时能量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-在三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。回答下列问题:
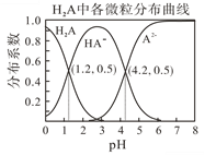
(1)H2A的电离方程式是__________________,二级电离常数K2=_________。
(2)已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1L密闭容器中充入1molCO2和3molH2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5molH2和0.5molH2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】298 K时,在20.0mL 0.10mol/LH2SO4溶液中滴入0.10 mol/L的NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列叙述正确的是
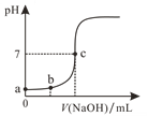
A.滴定过程最好用甲基橙作指示剂
B.a点溶液的pH=1.0
C.b点溶液中c(H+)=0.05mol/L
D.c点对应的NaOH溶液体积为20.0mL
查看答案和解析>>
科目: 来源: 题型:
【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
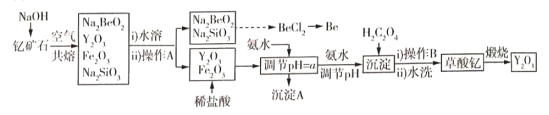
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al-Cu-Mg-Zn系。Cu在元素周期表中的位置是_____________,比较第一电离能Al______Mg(填“>”“<”“=”)。
(2)查阅资料显示第二电离能Cu大于Zn,理由是_______________。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___________________。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为_______。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___________,S的_______杂化轨道与O的2p轨道形成_____键(填“π”或“σ”)。
(5)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为________g/cm3(用含a、NA的计算式表示)。
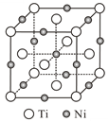
(6)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于_________晶体,CO与Fe之间的化学键称为________。与CO互为等电子体的分子或离子是______(只写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物W是一种药物的中间体,一种合成路线如图:

已知:①![]()
②![]()
请回答下列问题:
(1)A的系统命名为___。
(2)反应②的反应类型是__。
(3)反应⑥所需试剂为___。
(4)写出反应③的化学方程式为___。
(5)F中官能团的名称是___。
(6)化合物M是D的同分异构体,则符合下列条件的M共有__种(不含立体异构)。
①1molM与足量的NaHCO3溶液反应,生成二氧化碳气体22.4L(标准状态下);
②0.5molM与足量银氨溶液反应,生成108gAg固体其中核磁共振氢谱为4组峰且峰面积比为6∶2∶1∶1的结构简式为__(写出其中一种)。
(7)参照上述合成路线,以C2H5OH和![]() 为起始原料,选用必要的无机试剂合成
为起始原料,选用必要的无机试剂合成![]() ,写出合成路线__。
,写出合成路线__。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T0时,X(g)和Y(g)在2 L的密闭容器中发生反应生成Z(g),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述中错误的是
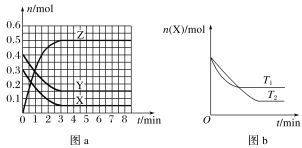
A.反应的方程式为X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.X(g)与Y(g)生成Z(g)的反应是放热反应
C.图a中反应达到平衡时,Y的转化率为62.5%
D.T1时,若该反应的平衡常数K的值为50,则T1>T0
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是
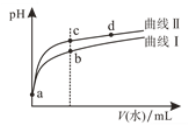
A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中![]() 保持不变
保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com