
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物。由此可知,下列说法正确的是( )
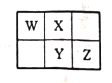
A.X形成的单核阴离子的还原性大于Y形成的单核阴离子的还原性
B.Y、Z的氧化物对应水化物的酸性一定是Y的强于Z的
C.X、Y、Z的最简单氢化物中稳定性最弱的是Y的氢化物
D.Z的单质在化学反应中只能表现出氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】二价铬不稳定, 极易被氧气氧化。醋酸亚铬水合物{ [Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示:
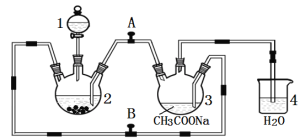
制备过程中发生的反应如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g);
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO—(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)仪器1的名称是 , 所盛装的试剂是 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是 。
(3)实验开始生成H2气后, 为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应 阀门A、 阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是 , 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,请计算该实验所得产品的产率 。
(6)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2白色沉淀现象。则在1、2、3中应装入的试剂依次为 、 、 。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.使甲基橙试液变红的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.常温下,![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.溶质为![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】某单烯烃A(C8H16)可以发生如下图示的转化,回答下列问题:

已知: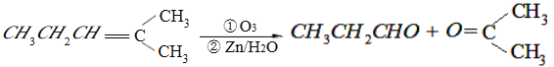
(1)B的分子式为___________________,D中含有官能团的名称___________________。
(2)B无银镜反应, D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),请写出E的结构简式____________________________________,D→E的反应类型___________________________。
(3)写出C→F的化学方程式_________________________________。
(4)H的同分异构体中,满足下列要求的结构一共有____________种(不考虑立体异构,包括H本身)
①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物
(5)已知: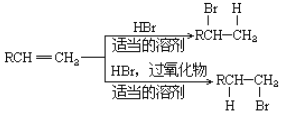 。
。
请写出由C制备2-丙醇的合成路线_____________________(无机原料任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
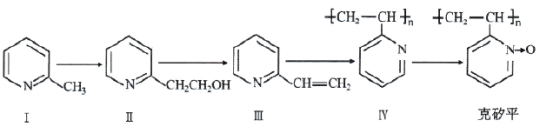
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生反应生成 :该反应类型为______。
:该反应类型为______。
(2)已知化合物Ⅰ生成化合物Ⅱ是原子利用率 100%的反应,则所需另一种反应物的分子式为_____。
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是_____(填字母)。
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)下列化合物中,能发生类似于“Ⅲ→Ⅳ”反应的是(__________)
A.乙烷 B.乙烯 C.乙醇 D.苯
查看答案和解析>>
科目: 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
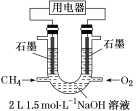
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的( )

A.人体血液的pH在7.35~7.45之间,用药后人体中含As元素的主要微粒是AsO33-
B.n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液显酸性
C.当pH调至11时发生反应的离子方程式是H3AsO3+OH-=H2AsO3-+H2O
D.pH=12时,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知,四边形![]() 内接于
内接于![]() ,
,![]() ,连接
,连接![]() 、
、![]() 交于点
交于点![]() .
.

(1)如图![]() ,求证:
,求证:![]() ;
;
(2)如图![]() ,过点
,过点![]() 作
作![]() 于点
于点![]() ,若
,若![]() ,求证:
,求证:![]() ;
;
(3)如图![]() ,在(2)的条件下,作
,在(2)的条件下,作![]() ,
,![]() 交
交![]() 于点
于点![]() ,
,![]() 交
交![]() 于点
于点![]() ,且
,且![]() ,若
,若![]() ,
,![]() ,求
,求![]() 的半径.
的半径.
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品。
(1)标准状况下,1 mol NH3的体积约为________L。
(2)实验室制取NH3的化学方程式为______________。
(3)收集NH3应使用________法,要得到干燥的NH3可选用___做干燥剂。
(4)压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与 NH3 含量的一些实验数据:
压强MPa | 10 | 20 | 30 | 60 | 100 |
NH3含量(体积分数%) | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量随之___(填字母)。
A.增大 B.减小 C.先增大再减小 D.不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com