
科目: 来源: 题型:
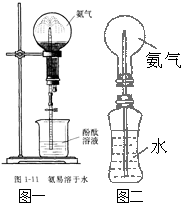 某同学受图一演示实验的启发,设计了一个由不太易变形的矿泉水瓶与烧瓶组成的简易装置(图二),以方便、快速做喷泉的实验,但实际操作中发现喷泉稍有产生不久即停止.下列改进可行的是( )
某同学受图一演示实验的启发,设计了一个由不太易变形的矿泉水瓶与烧瓶组成的简易装置(图二),以方便、快速做喷泉的实验,但实际操作中发现喷泉稍有产生不久即停止.下列改进可行的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体.
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:阅读理解
 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com