
科目: 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目: 来源: 题型:






| 一定条件 |
 +nH2O
+nH2O
| 一定条件 |
 +nH2O
+nH2O


查看答案和解析>>
科目: 来源: 题型:








 、
、
 、
、
查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:阅读理解
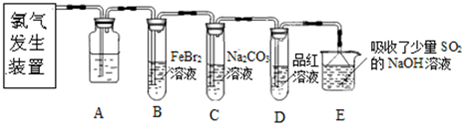
查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:| C(H2)?C(CO) |
| C(H2O) |
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目: 来源: 题型:
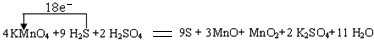
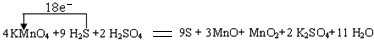
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com