
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
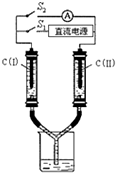 电化学在工业生产中有广泛应用.
电化学在工业生产中有广泛应用.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
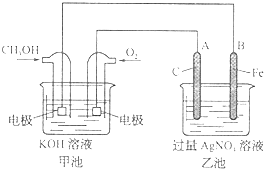 据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH| 放电 | 充电 |
查看答案和解析>>
科目: 来源: 题型:
 HSO3-+OH-,加入BaCl2后,
HSO3-+OH-,加入BaCl2后, HSO3-+OH-,加入BaCl2后,
HSO3-+OH-,加入BaCl2后,查看答案和解析>>
科目: 来源: 题型:阅读理解
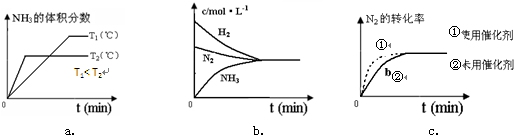
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 1 |
| 12 |
| 1 |
| 12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com