(2010?天津)纳米TiO
2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO
2的方法之一是TiCl
4水解生成TiO
2?x H
2O,经过滤、水洗除去其中的Cl
-,再烘干、焙烧除去水分得到粉体TiO
2.用现代分析仪器测定TiO
2粒子的大小.用氧化还原滴定法测定TiO
2的质量分数:一定条件下,将TiO
2溶解并还原为Ti
3+,再以KSCN溶液作指示剂,用NH
4Fe(SO
4)
2标准溶液滴定Ti
3+至全部生成Ti
4+.
请回答下列问题:
(1)TiCl
4水解生成TiO
2?x H
2O的化学方程式为
TiCl
4+(x+2)H
2O

TiO
2?xH
2O↓+4HCl
TiCl
4+(x+2)H
2O

TiO
2?xH
2O↓+4HCl
.
(2)检验TiO
2?x H
2O中Cl
-是否被除净的方法是
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
.
(3)下列可用于测定TiO
2粒子大小的方法是
d
d
(填字母代号).
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(4)配制NH
4Fe(SO
4)
2标准溶液时,加入一定量H
2SO
4的原因是
抑制NH4Fe(SO4)2水解
抑制NH4Fe(SO4)2水解
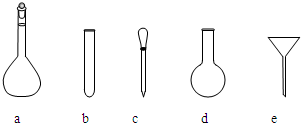
;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要图中的
a、c
a、c
(填字母代号).
(5)滴定终点的现象是
溶液变为红色
溶液变为红色
.
(6)滴定分析时,称取TiO
2(摩尔质量为M g?mol
-1)试样w g,消耗c mol?L
-1 NH
4Fe(SO
4)
2标准溶液V mL,则TiO
2质量分数表达式为
.
(7)判断下列操作对TiO
2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH
4Fe(SO
4)
2溶液有少量溅出,使测定结果
偏高
偏高
.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果
偏低
偏低
.


 TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl