
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN | |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度mol/L | 1.8×10-10 | 7.1×10-7 | 1.1×10-8 | 1.9×10-12 | 1.0×10-6 |
查看答案和解析>>
科目: 来源: 题型:
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.
某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.

| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4162 | 18.25 |
| 2 | 17.04 | |
| 3 | 16.96 |
查看答案和解析>>
科目: 来源: 题型:
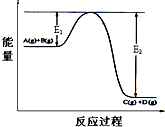 反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.| c2(C)c(D) |
| c(A)c(B) |
| c2(C)c(D) |
| c(A)c(B) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com