
研究性学习小组为探究Cu与浓H
2SO
4反应及其产物SO
2的性质,设计如下实验装置:
(1)写出铜与浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+SO
2+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2+2H
2O
;浸有碱液的棉花的作用是:
吸收SO2防止污染空气
吸收SO2防止污染空气
.
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO
2的性质,经过同学间的讨论和与老师的交流,设计了如图实验装置.

①对试管A中的浓H
2SO
4和铜丝进行加热,发现E试管中有气泡逸出,品红溶液 很快褪色,但最终 未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 |
溶解度(g/100水) |
物质 |
溶解度(g/100水) |
| Ca(OH)2 |
0.173 |
Ba(OH)2 |
3.89 |
| CaCO3 |
0.0013 |
BaSO3 |
0.016 |
| Ca(HCO3)2 |
16.60 |
|
|
他们应用类比研究方法预测了D试管未出现浑浊的原因:
生成了溶解度较大的Ba(HSO3)2
生成了溶解度较大的Ba(HSO3)2
.
②为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成实验报告.
| 实验方案 |
现象 |
| 1取少量溶液于试管中,加入氢氧化钠溶液 |
|
| 2取少量溶液于试管中,加入稀盐酸,加热,用湿润的蓝色石蕊试纸检验生成的气体. |
|
(3)实验结束后,发现试管A中还有铜片剩余.该小组的同学根据所学的化学知识认为硫酸也有剩余.下列药品中能够用来证明反应结束后的试管A中确有余酸的是
A D
A D
(填写字母编号).
A.铝粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(4)请写出长导管B的作用
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
(只写一点就可).

 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:




 研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
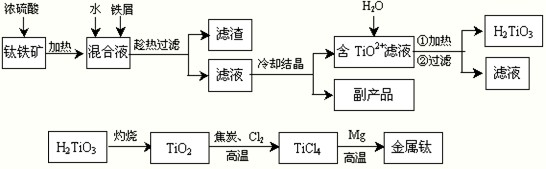
 H2TiO3+2H+
H2TiO3+2H+ H2TiO3+2H+
H2TiO3+2H+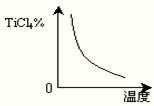
 W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.
