某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO
4?7H
2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
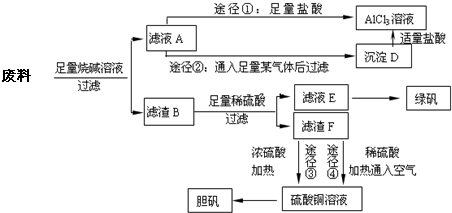
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.
(2)由滤液A制AlCl
3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是
CO2
CO2
(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.你认为较合理的途径是
②
②
(填①或②),理由是
途径①会引入盐酸,氯化钠杂质
途径①会引入盐酸,氯化钠杂质
.
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe
2+和H
+外,还最可能存在的阳离子是
Fe3+
Fe3+
(用离子符号表示),检测该离子的方法是
取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
.
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是
产生等量胆矾途径④消耗硫酸少
产生等量胆矾途径④消耗硫酸少
、
途径④不会产生污染大气的气体
途径④不会产生污染大气的气体
.
(5)途径③发生的反应中,体现了浓硫酸
强氧化
强氧化
性和
酸
酸
性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、
过滤
过滤
、自然干燥.其中途径④发生的反应为
2Cu+O2+4H+=2Cu2++2H2O
2Cu+O2+4H+=2Cu2++2H2O
(用一个离子方程式表示).



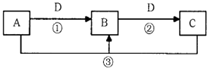 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空: