印刷电路的废腐蚀液含有大量CuCl
2、FeCl
2和FeCl
3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl
3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl
2 1.5mol?L
-1、FeCl
23.0 mol?L
-1、FeCl
3 1.0mol?L
-1、HCl3.0mol?L
-1.取废腐蚀液200mL按如下流程在实验室进行实验:
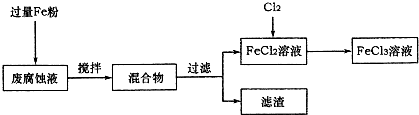
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
;
②检验废腐蚀液中含有Fe
3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
漏斗
漏斗
.
③由滤渣得到纯铜,除杂所需试剂是
盐酸
盐酸
.
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl
2溶液中获得FeCl
3溶液.
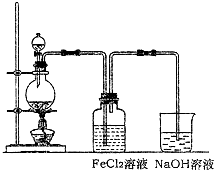
①实验开始前,某同学对实验装置进行了气密性检查,方法是
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
.
②浓盐酸与二氧化锰反应的化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
;
烧杯中NaOH溶液的作用是
吸收多余氯气,防止尾气处理
吸收多余氯气,防止尾气处理
.
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl
2的物质的量应不少于
0.75
0.75
mol.