
科目: 来源: 题型:
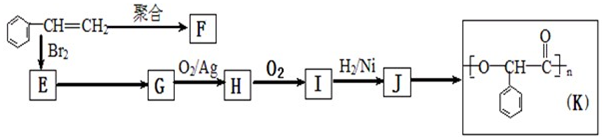


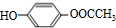
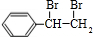 +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr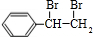 +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr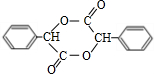


查看答案和解析>>
科目: 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (2013?黄山一模)如图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的a极板、b极板、X电极、Z溶液是( )
(2013?黄山一模)如图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的a极板、b极板、X电极、Z溶液是( )查看答案和解析>>
科目: 来源: 题型:
(2013?黄山一模)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com