
科目: 来源: 题型:













 是否互为同分异构体
是否互为同分异构体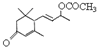 的同分异构体有
的同分异构体有

查看答案和解析>>
科目: 来源: 题型:阅读理解
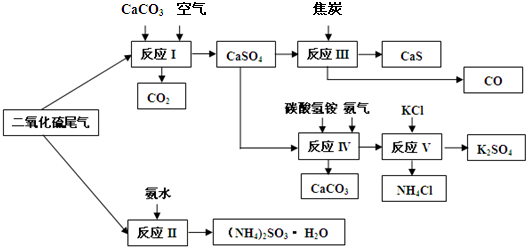
| ||
查看答案和解析>>
科目: 来源: 题型:
 (2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
(2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |

查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | +5、-3 | +4、-4 | +5、-3 | +3 |


查看答案和解析>>
科目: 来源: 题型:
(2012?丰台区一模)某无色溶液可能含有①Na+ ②Ba2+ ③Cl一 ④Br一 ⑤SO32一 ⑥SO42一中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com