
科目: 来源: 题型:
 (2011?佛山一模)纯碱、烧碱等是重要的化工原料.
(2011?佛山一模)纯碱、烧碱等是重要的化工原料.| 实验步骤 | 预期现象和结论 |
| 步骤1: | 产生白色沉淀,说明固体中含有Na2CO3 产生白色沉淀,说明固体中含有Na2CO3 |
| 步骤2: | 溶液变红色,说明固体中含有NaOH 溶液变红色,说明固体中含有NaOH |
| 步骤3: | 空 空 |
查看答案和解析>>
科目: 来源: 题型:
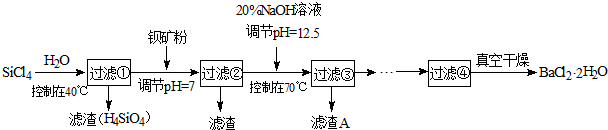
查看答案和解析>>
科目: 来源: 题型:
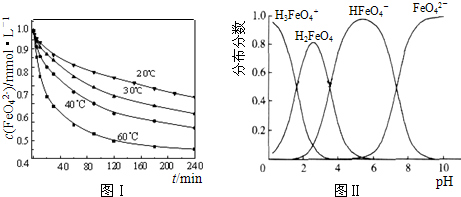
| c(H+).c(FeO42-) |
| c(HFeO4-) |
| c(H+).c(FeO42-) |
| c(HFeO4-) |
查看答案和解析>>
科目: 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
| A组 | B组 | C组 | D组 | |
| 分类标准 | 金属氧化物 | 非金属单质 非金属单质 |
金属单质 | 酸 酸 |
| 不属于该类别的物质 | CO2 CO2 |
Cu | O2 O2 |
H2O |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com