
科目: 来源: 题型:
 Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是查看答案和解析>>
科目: 来源: 题型:
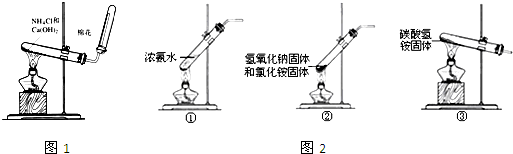
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
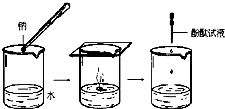 钠与水反应的离子方程式是
钠与水反应的离子方程式是| 实验现象 | ⑦ | ④ ④ |
③ | ② ② |
| 实验结论 | ⑧ ⑧ |
⑥ | ⑤ ⑤ |
① |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com