
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 一定条件 |
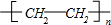
| 一定条件 |
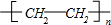
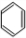 +Br2
+Br2| FeBr3 |
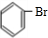 +HBr
+HBr +Br2
+Br2| FeBr3 |
 +HBr
+HBr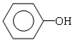 )和丙酮(CH3COCH3).生产流程如下:
)和丙酮(CH3COCH3).生产流程如下: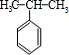

 +O2
+O2| 催化剂 |
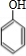 +
+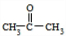
 +O2
+O2| 催化剂 |
 +
+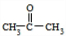

查看答案和解析>>
科目: 来源: 题型:
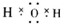
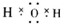
查看答案和解析>>
科目: 来源: 题型:
 在一定温度下,M、N两种气体在容积为VL的恒容密闭容器中进行反应,气体的物质的量随时间的变化曲线如图所示:
在一定温度下,M、N两种气体在容积为VL的恒容密闭容器中进行反应,气体的物质的量随时间的变化曲线如图所示: M
M M
M查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 绝大部分金属的冶炼都是通过再高温下发生的氧化还原反应来完成的,实验室利用铝热反应来模拟这种冶炼方法,实验装置如图.
绝大部分金属的冶炼都是通过再高温下发生的氧化还原反应来完成的,实验室利用铝热反应来模拟这种冶炼方法,实验装置如图.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
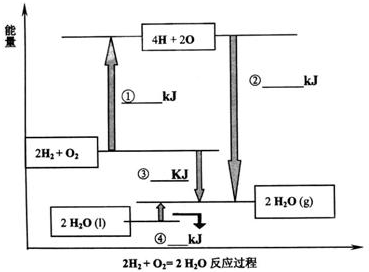
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com