
科目: 来源: 题型:
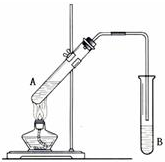 在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按图所示连接好装置制取乙酸乙酯.
在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按图所示连接好装置制取乙酸乙酯.查看答案和解析>>
科目: 来源: 题型:
下列是某同学对相应反应的方程式所作的评价,其中评价合理的是( )
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
| A、发黄的浓硝酸中通入适量O2,可除去其中溶解的NO2 | B、乙酸乙酯粗品中,加入足量NaOH溶液振荡、分液,以除去其中溶解的乙酸和乙醇 | C、电石与水产生的乙炔气通入酸性高锰酸钾溶液,紫色褪去,说明其中含有H2S气体杂质 | D、除去氧化膜的铝片,先放入冷的HClO4溶液中浸泡10分钟,然后放在硫酸铜溶液中,铝片表面无铜析出,说明冷的HClO4溶液也能使铝钝化 |
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 向1,2两试管中分别加入等浓度H2O2溶液10mL、1mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 | 证明FeCl3溶液的催化效率更高 |
| B | 将洁净的铁钉在饱和食盐水中浸泡一段时间;铁钉上有气泡产生 | 证明铁发生析氢腐蚀 |
| C | 测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH | 证明盐酸酸性比醋酸强 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
查看答案和解析>>
科目: 来源: 题型:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
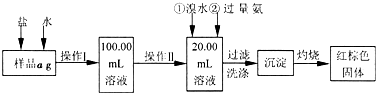
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com