
科目: 来源: 题型:阅读理解
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行探究:
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U型管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
 (2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式_______________________
若否,指出产生该现象的原因:________________________。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U型管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:______________________________
(如果回答次题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是:____________________________
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:___。
查看答案和解析>>
科目: 来源: 题型:
将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO ![]() CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡 所需时间 | ||
H2O | CO | H2 | CO | |||
l | 650℃ | lmol | 2mol | 0.6mol | 1.4mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为![]() 、Ka2,且
、Ka2,且![]() ≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是 ( )
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
查看答案和解析>>
科目: 来源: 题型:
下列对气体或溶液中的离子鉴定方案正确的是 ( )
A.将气体通入品红溶液中,品红溶液褪色,则证明该气体为SO2
B.向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中含CO32-
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42-
D.向溶液中加入浓NaOH溶液,加热后产生使湿润的pH试纸变蓝的气体,证明原溶液中含NH4+
查看答案和解析>>
科目: 来源: 题型:
下表中的数据是破坏1mol物质中的化学键所消耗的能量(在25℃,101kPa下测定):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
下列叙述正确的是 ( )
A.上述物质中所含能量最低的是I2
B.H2(g)+Cl2(g)=2HCl(g) △H=+185kJ/mol
C.相同条件下,X2(X代表Cl、Br、I)分别与1 molH2 完全反应,Cl2放出的能量最多
D.在卤素单质X2 (X代表Cl、Br、I)中,Cl―Cl键键能最大,所以氯气化学性质最稳定
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的叙述中,正确的是 ( )
①用湿润的pH试纸测定溶液的pH
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体 .
③可用加热法分离I2和NH4Cl的混合物
④可用稀硝酸洗涤“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH),胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁粉
A.①②④ B.②⑧⑥ C.②④⑥ D.②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
现有某温度下的KCl饱和溶液![]() ,溶质的质量分数为
,溶质的质量分数为![]() ,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为
,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为![]() ,溶质的质量分数为
,溶质的质量分数为![]() ,则下列关系正确的是 ( )
,则下列关系正确的是 ( )
A.原条件下KCl的溶解度等于![]() B.
B.![]()
C.![]() 一定等于
一定等于![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
A元素原子最外层电子数是次外层电子数的2倍,B元素原子次外层电子数是最外层电子数的2倍。则A、B元素 ( )
A.可能是同一主族元素 B.一定都是第二周期元素
C.可能都是第三周期元素 D.一定是两种非金属元素
查看答案和解析>>
科目: 来源: 题型:
2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是 ( )
A.用“绿色化学”工艺,使原料完全转化为目标产物
B.推广燃煤脱硫技术,减少SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥以提高粮食产量
查看答案和解析>>
科目: 来源: 题型:
已知有机物A不能发生银镜反应,也不能使溴水褪色;在一定条件下,A的苯环上发生卤代反应时只能产生两种一卤代物;A在一定条件下还能发生如下图所示的反应。B与过量的银氨溶液能发生银镜反应;C中具有八元环结构;D溶液中加入浓硝酸会有白色沉淀产生,加热,沉淀变黄色;E能使溴水褪色。
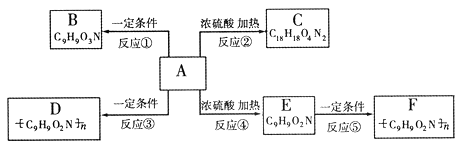
请回答:
(1)写出A的化学式:__ __
(2)写出下列变化的基本反应类型:
A![]() C:__ __ E
C:__ __ E![]() F: ___
F: ___
(3)写出D的结构简式:_ __
(4)B发生银镜反应的离子方程式
(5)若E中的苯环和各官能团均保持不变,苯环上取代基的数目、位置和化学式也不改变。则符合上述条件的E的同分异构体(除E外)还有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com