
科目: 来源: 题型:
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
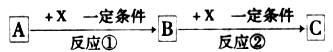
试回答:
(1)若X是强氧化性单质,则A不可能是_________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向c的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为_________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)__________________,检验此C溶液中金属元素价态的操作方法是____________________________________。
(3)若A、B、C为含有金属元素的元机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式可能为_________,X的化学式可能为(写出不同类物质)_________或_________,反应①的离子方程式为_________或_________。
查看答案和解析>>
科目: 来源: 题型:
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为__________________。
(2)C2B2的电子式为_________,其中含有的化学键类型为_________。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入Ⅺ淀粉溶液中,溶液变为蓝色,则反应离子方程式为_________。
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为____________________,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为_________,外电路中通过电子的物质的量为_________。
(5)实验室欲检验CD溶液中所含的![]() ,操作方法和现象为_______________________
,操作方法和现象为_______________________
查看答案和解析>>
科目: 来源: 题型:阅读理解
某研究性学习小组对铝热反应实验展开研究。某高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ― |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答_________(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol? L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试回答下列问题:
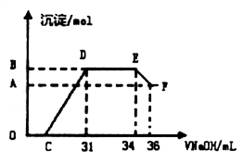
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_________;上述现象说明溶液中的离子结合![]() 的能力最强的是________最弱的是________(填离子符号)。
的能力最强的是________最弱的是________(填离子符号)。
(3)B与A的差值为_________mol。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作或事故处理中,正确的做法是_________
A.银镜反应实验后附有银的试管,可用氨水清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.在250mL烧杯中加入216mL水和24gNaOH固体,配制质量分数为l0%NaOH溶液
F.发生急性硫化氢中毒,应迅速将患者转移到空气新鲜的地方,对患者实行人工呼吸,并迅速送医院救治。
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
H.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
I.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
查看答案和解析>>
科目: 来源: 题型:
在某容积一定的密闭容器中,可逆反应:
A(g)+B(g) ![]() Xc(g)
Xc(g)![]() ,符合下图所示图像(1)的关系。由此推断对图像(2)的正确说法是( )
,符合下图所示图像(1)的关系。由此推断对图像(2)的正确说法是( )
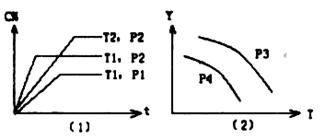
A.P3>P4,Y轴表示A的转化率
B.P3<P4,Y轴表示B的百分含量
C.P3>P4,Y轴表示混合气体密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目: 来源: 题型:
在恒容条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)![]() 在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | l | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | l | Q3 |
A.在上述条件下反应生成1molSO3固体放热Q/2kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目: 来源: 题型:
氢化铵(NH4H)与氯化铵的结构相似,又如NH4H与水反应有氢气生成,下列叙述正确的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体投入少量水中,有两种气体生成
查看答案和解析>>
科目: 来源: 题型:
常温下,![]() 某一元酸(HA)溶液中
某一元酸(HA)溶液中![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.溶液中水电离出的![]()
B.溶液中![]()
C.与![]() NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:
NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:![]()
D.原溶液中加入一定量CH3COONa晶体或加水稀释,溶液的![]() 均增大
均增大
查看答案和解析>>
科目: 来源: 题型:
下列是除去括号内杂质的有关操作,其中正确的是( )
A.分离苯和己烷:蒸馏
B.NO(NO2)――通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)――让气体通过盛酸性高锰酸钾溶液的洗气瓶
D.乙醇(乙酸)――加足量NaOH溶液,蒸馏
查看答案和解析>>
科目: 来源: 题型:
下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
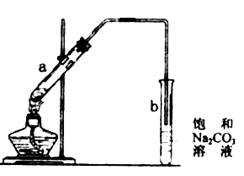
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com