
科目: 来源: 题型:
表示下列变化的式子正确的是( )
A.NaHCO3水解的离子方程式:HCO![]() +H2O
+H2O ![]() H3O++CO
H3O++CO![]()
B.石灰石溶于醋酸的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O
C.钢铁电化学腐蚀的负极反应:4OH--4e-=2H2O+O2↑
D.1 L 0.5mol/L H2SO4溶液与1 L 1.0mol/L NaOH溶液反应,放出57.3kJ的热量:
1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.标准状况下,22.4LCl2参加反应所得的电子数不一定是2NA(NA为阿伏加德罗常数)
B.第IA族和第VIA族元素间不可能形成原子个数比为1:1的离子化合物
C.非金属单质在固态时都属于分子晶体
D.水分子中,每个氧原子周围有4个氢原子,并分别与之形成氢键
查看答案和解析>>
科目: 来源: 题型:
工业制硫酸铜不是直接用铜和浓H2SO4反应,而是将粗铜(含少量银)浸入稀H2SO4中,并不断从容器下部通入细小的空气泡。有关制备方法的叙述中,正确的是( )
①该方法运用了原电池工作原理 ②该方法运用了电解池工作原理 ③该方法不产生污染环境的SO2 ④该方法提高了硫酸的利用率 ⑤该方法提高了铜的利用率
A.①③⑤ B.①③④ C.②③④ D.①③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列实验操作中,错误的是( )
A.配 5%配食盐溶液时,将称量的食盐放入烧杯中,加计量的水搅溶解即可
B.硫酸铜晶体结晶水含量测定时,需边加热边搅拦,防止晶体飞溅
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.中和热测定实验中,应用环型玻璃搅拌棒轻轻搅动混合液
查看答案和解析>>
科目: 来源: 题型:
下列关系中正确的是( )
A.原子半径:K>Mg>Na B.热稳定性:HCl>PH3>H2S
C.氧化性:Cu2+>Ca2+>Al3+ D.酸性:HNO3>H3PO4>H3AsO4
查看答案和解析>>
科目: 来源: 题型:
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/cm3,遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应(该反应为放热反应)合成二氯化硫的实验装置。
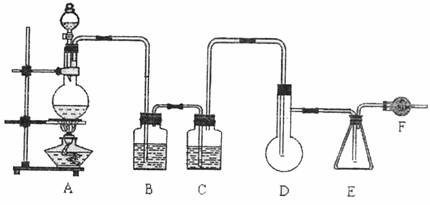
试填写下列空白:
(1)装置A中发生反应的离子方程式为: ,装置B盛放的药品是 ,C中盛放的药品是 。
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(3)实验时,D装置需将加热温度控制在50℃―59℃,最好采用 加热。为了防止E中所得液体挥发,采用的措施是 。
(4)F装置的作用是: 。
(5)由SCl2与SO3作用生成SOCl2的化学方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。
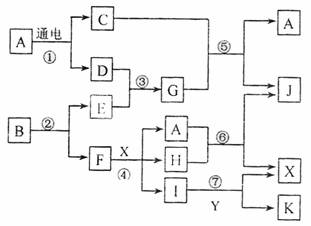
请按要求填空:
(1)写出下列物质的化学式
A 、E 、Y
(2)反应⑤的化学方程式为: 。
(3)常温下,G和X反应生成Z,写出鉴定Z中阳离子的实验方法和现象:
。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为
。
查看答案和解析>>
科目: 来源: 题型:
水的电离平衡曲线如下图所示:
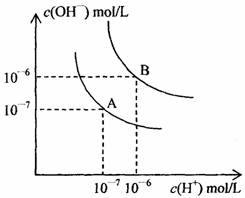
①若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。造成水的离子积增大的原因是 。
②100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液和硫酸溶液的体积比为 ,此溶液中各种离子浓度由大到小排列的顺序是 。
查看答案和解析>>
科目: 来源: 题型:
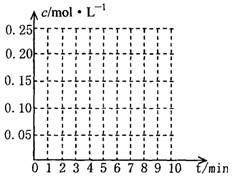
在20L恒容的密闭容器中,加入3molSO3(g)和1molO2(g),在一定温度下使其反应,反应至4min时,O2的浓度为0.08mol/L,当反应进行到8min时,反应达到平衡,此时SO3的浓度c(SO3)=amol/L。
①0min~4min内生成O2的平均速率为v(O2)= mol?L-1?min-1
②达到平衡时,c(O2)=c(SO2),则a= 。在下图坐标系中作出0min~8min及之后O2、SO3浓度随时间变化的曲线。
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、丁、戊是五种短周期元素,它们的原子序数依次增大,其中甲和丙,乙和丁分别是同主族元素,丁和戊两元素同周期相邻。又知乙、丁两元素的原子核内质子数之和是甲、丙两元素原子核内质子数之和的2倍,甲元素的一种同位素核内无中子。请回答:
(1)乙元素原子结构示意图为 ,丙、丁两元素形成的常见化合物的电子式为 。
(2)甲、乙、丁可形成A、B两种微粒,它们均为-1价双原子阴离子,且A有18个电子,B有10个电子,则A和B反应的离子方程式为 。
(3)1L 0.5mol/L丙的最高价氧化物的水化物与1L 0.5mol/L丁的最高价氧化物的水化物反应,放出28.65kJ热量,该反应的热化学方程式为
。
(4)将丁单质与戊单质的水溶液充分反应可以生成两种强酸,该反应的化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com