
科目: 来源: 题型:
“钴酞菁”分子(直径约为1![]() )结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 在分散系中,“钴酞菁”分子的直径比Na+的直径小
D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
查看答案和解析>>
科目: 来源: 题型:
下列有关安全问题的叙述不正确的是( )
A. 室内使用煤炉取暖时,为防止煤气中毒应确保煤充分燃烧和烟道通畅
B. 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域
C. 家中发生天然气泄露时,应立即使用室内电话报警
D. 家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体
查看答案和解析>>
科目: 来源: 题型:
下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
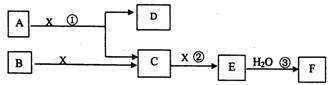
(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L?min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E五种短周期元素,原子序数依次增大。A元素原子内无中子;B、C、D同周期;B元素原子最外层电子数是次外层的2倍;D是地壳中含量最多的元素;E与A同主族。回答下列问题:
(1)画出E元素的离子结构示意图______________。
(2)D、E形成的一种化合物甲能与B、D形成的一种化合物乙反应,生成D的单质。写出甲与乙反应的化学方程式____________________________________。
(3)采用石墨为电极,电解A、D、E三种元素所形成的一种化合物,其阳极电极反应为__________________。
(4)A、C能形成一种常见气体丙,其分子为________分子(填“极性”或“非极性”);丙的电子式为______________;实验室制取气体丙的化学方程式为_______________。
(5)在一定条件下,lmol气体丙还可与D的单质反应,生成水蒸气和另一种气体,同时转移![]() 个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为_________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
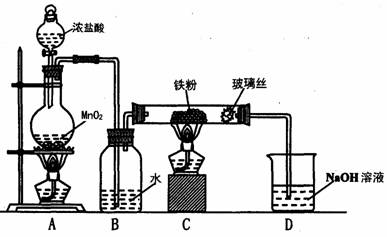
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
咖啡酸( )也叫3,4―二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
)也叫3,4―二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是____________________。
(2)咖啡酸不具有以下哪些化学性质__________(填写序号字母)。
A. 有浓硫酸、加热条件下能发生消去反应
B. 能与FeCl3溶液发生显色反应
C. 能发生银镜反应
D. 一定条件下能发生酯化反应
(3)1mol咖啡酸跟浓溴水反应时最多消耗______molBr2,反应类型有
____________________________________________________________。
(4)写出咖啡酸一定条件下发生加聚反应的方程式
____________________________________________________________。
写出咖啡酸与NaHCO3溶液反应的方程式
____________________________________________________________。
(5)写出符合下列条件的有机物A的结构简式
有机物A的分子式为C9H10O2;分子中有一个甲基;A能发生水解反应;在溶液中1molA能与2molNaOH反应
____________________________________________________________。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成yg H2O和mLCO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式____________________。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. 若酸性![]() ,则相同条件下,溶液的pH大小为
,则相同条件下,溶液的pH大小为![]()
B. 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大
C. pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是![]()
D. ![]() 的某二元弱酸盐
的某二元弱酸盐![]() 溶液中,
溶液中,![]()
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. 只有非金属能形成含氧酸和含氧酸盐
B. VIA族元素的氢化物中稳定性最好的,其沸点也最高
C. 同一主族的元素,原子半径越大其单质的熔点越高
D. 除稀有气体外的非金属元素,都能形成不同价态的含氧酸
查看答案和解析>>
科目: 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )

A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com