
科目: 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关x的说法中不正确的是( )
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
A.含有非极性共价键的化合物分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰主要是水分子通过氢键作用而形成的分子晶体
D.若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q
查看答案和解析>>
科目: 来源: 题型:
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是( )

A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
查看答案和解析>>
科目: 来源: 题型:
用KMnO4晶体和浓盐酸制取氧气和氯气。取0.2molKMnO4晶体先加热制得一定量的氧气后停止加热,再将残留物与过量浓盐酸混合、加热,得到Cl2,此时溶液中的主要离子是K+、Mn2+、H+、Cl-。计算:
(1)KMnO4晶体完全分解时制得的氧气在标准状况下的体积。
(2)将(1)中完全分解的固体产物与过量的浓盐酸反应,可制得Cl2的物质的量。
(3)若最后得到的Cl2为0.48mol,则KMnO4制氧气时的分解率。
查看答案和解析>>
科目: 来源: 题型:
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池原混合溶液中Cu2+的浓度。
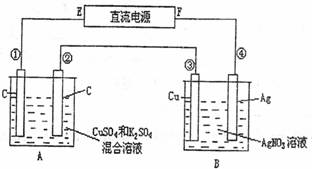
查看答案和解析>>
科目: 来源: 题型:
在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体的总质量 | 测得晶体中结晶水个数 |
| 11.7g | 22.7g | 18.6g |
(5)这次实验中产生误差的原因可能是 (填选项)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
查看答案和解析>>
科目: 来源: 题型:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内,并标出电子转移的方向和数目。
![]()
(2)反应中,被还原的元素是 ,还原剂是 。
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三种元素,X与氢能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%,Z是最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称),它属于晶体。
(2)Y的氢化物属于 晶体,它的电子式是 。
(3)Z元素位于周期表第 周期第 族,它的氢化物是 (填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 ,它的晶体属于晶体。
查看答案和解析>>
科目: 来源: 题型:
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:

阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2molNaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
查看答案和解析>>
科目: 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.652kJ的热量。
(1)该反应的热化学方程式是 。
(2)又已知H2O(l)==H2O(g);△H=-44kJ?mol-1,由16g液态肼与液态过氧化氢反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com