
科目: 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
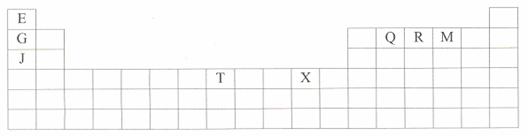
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发出了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
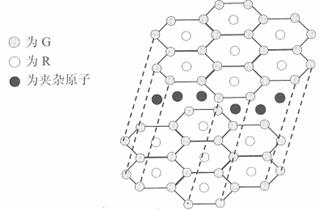
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)
查看答案和解析>>
科目: 来源: 题型:
香精(![]() )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
已知:①A只有两种一氯代物B和C
②
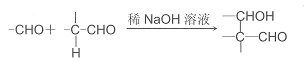
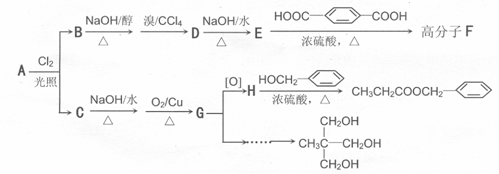
回答下列问题:
(1)和![]() 互为同分异构体的是: (填序号)
互为同分异构体的是: (填序号)
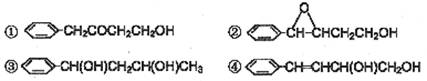
(2)D物质的名称为:
(3)由E合成F的化学方程式为: ;反应类型为
(4)工业用CH3CH2COONa和![]() 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为
。
(5)以G和某种一元醛和必要的无机试剂为原料合成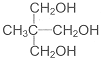 ,写出合成路线(注明条件,不要求写化学方程式) 。
,写出合成路线(注明条件,不要求写化学方程式) 。
查看答案和解析>>
科目: 来源: 题型:
食品安全关系国民重生计,影响食品安全的因素很多。
(1)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由 (写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由 (写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4-CH=CH-CH2-CH=CH-(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是 。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:
查看答案和解析>>
科目: 来源: 题型:
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2Dz![]() Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
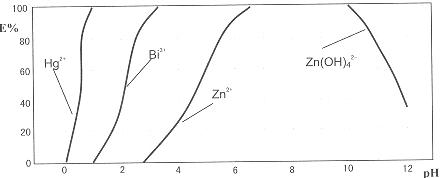
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
查看答案和解析>>
科目: 来源: 题型:
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法
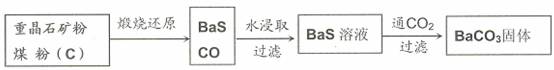
(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H= -1473.2 kJ?mol-1
C(s)+![]() O2(g)=CO(g);△H= -110.5 kJ?mol-1
O2(g)=CO(g);△H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s);△H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32(aq)![]() BaCO3(s)+SO42(aq)(平衡常数K=0.042)
BaCO3(s)+SO42(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
查看答案和解析>>
科目: 来源: 题型:
红钒钠(重铬酸钠:Na2Cr2O7?2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿(FeO?Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。
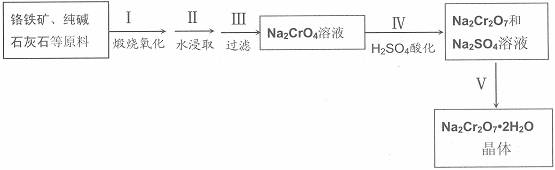 (1)步骤I的反应有:4 FeO?Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
(1)步骤I的反应有:4 FeO?Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7~8,并煮沸除去铝和硅的化合物,其离子方程式为:
(3)步骤IV反应为:2CrO42-+2H+= Cr2O72-+H2O,平衡常数表达式为:K=
下图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
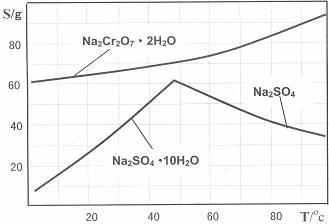
(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是
。
查看答案和解析>>
科目: 来源: 题型:
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是白色金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2白色固体,难溶于水,可溶于强碱及NH3?H2O; ④Zn2+易形成络合物如[Zn(NH3)4] 2+,该络合物遇强酸分解生成Zn2+、NH4+。 |
●提出假设:
(1)假设1:该混合金属粉末中除镁外还含有 元素
(2)假设2:该混合金属粉末中除镁外还含有 元素
假设3:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
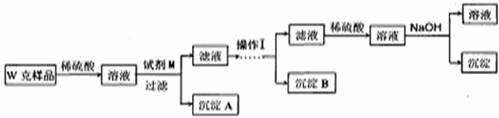
甲同学基于假设3设计实验方案如下:
乙同学同样基于假设3设计另一实验方案如下:
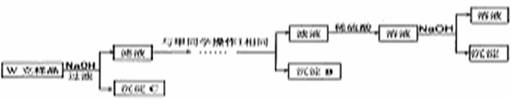
(3)试剂M是
(4)写出操作I的过程
(5)丙同学认为乙同学的方案比甲同学的好,理由是
(6)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了Wg样品中金属镁(Mg)的质量分数,他的方法是
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组探究溴的制备及提纯
●资料收集
| 溴 | 物理性质 | 暗红色液体,刺激性气味。室温下易挥发。熔点-7.2℃,沸点59.1℃。密度2.928g?cm-3。稍溶于冷水。 |
| 化学性质 | 溶于水生成次溴酸 |
●溴的制备
现只有下列试剂:溴化钾、MnO2、浓盐酸、稀硫酸、浓硫酸
(1)写出制取溴的化学方程式: 。
现只有下列仪器:(石棉网、导管、铁架台、塞子等略去)

(2)根据反应原理,制备和收集溴应该选择的仪器有: (填字母序号)。
●溴的提纯
实验室用蒸馏法提纯液溴,装置如图所示。
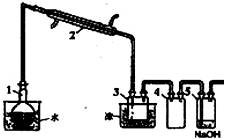
(3)蒸馏装置都用磨口玻璃器具,而不用橡胶管和橡胶塞连接,是因为
。
(4)装置4的作用是 。
(5)要想除去液溴中少量Cl2,可在液溴中加入 (填序号)后再分液分离即可。
①48%的氢溴酸 ②浓NaOH溶液 ③饱和KI溶液
查看答案和解析>>
科目: 来源: 题型:
碱式碳酸镁和无水氯化镁具有广泛的用途。
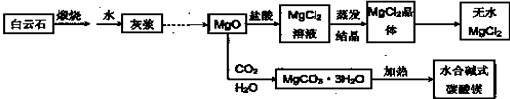
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成。某同学组装仪器如图所示:
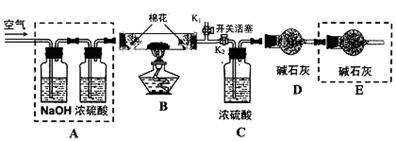
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是
。
(5)若将E框中的装置去掉,对实验结果的影响是 。
查看答案和解析>>
科目: 来源: 题型:
反应N2O4(g)![]() 2NO2(g);△H= +57 kJ? mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ? mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
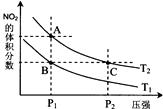
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com