
科目: 来源: 题型:
A、B、C三种元素的原子具有相同的电子层数,已知B的核电荷数比A多2个,C原子核中的质子数比B多4个;1mol单质A跟酸完全反应,能置换出1g H2,这时A转化为具有跟Ne相同的电子层结构的离子,根据上述条件,回答:
(1)三种元素分别为:A B C (填元素符号)
(2)A、B元素的最高价氧化物对应水化物的化学式分别为
和 ;C元素气态氢化物的化学式为 。
上述三种化合物相互发生反应的离子方程式是:
查看答案和解析>>
科目: 来源: 题型:
元素周期表中前7周期的元素数目如下表所示(假设第七周期已排满):
| 周期 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(1)第6、7周期比第4、5周期多了14种元素,其原因是 。
(2)周期表中 族所含元素最多。
(3)请分析周期数与元素数目的关系后预言第8周期最多可能含有的元素种数为( )
A.18 B.32 C.50 D.64
(4)如将现行族号取消,并按从左到右顺序将原有的各族依次称为1~18纵行,则32号元素锗(Ge)位于第 周期第 纵行。
查看答案和解析>>
科目: 来源: 题型:
(1)在下面元素周期表中全部是金属元素的区域为 。
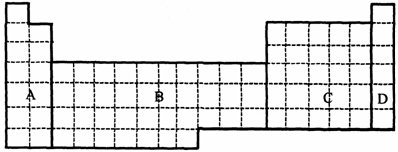
(a)A (b)B (c)C (d)D
(2)甲元素所形成的最高价氧化物对应的水化物酸性最强,乙元素所形成的气态氢化物最稳定,丙原子失去两个电子后与Ne具有相同的电子层结构,丁是元素周期表中第三周期第IIIA族的元素。
①用元素符号将甲乙丙丁元素填写在上面元素周期表中对应的位置。
②丙、丁两元素相比较,金属性较强的元素是 (填元素符号),可以验证该结论的实验是 。
(a)比较两种元素单质的熔点
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的最高价氧化物对应水化物的碱性
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目: 来源: 题型:
已知元素的电负性和原子半径、化合价等一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
试结合元素周期律知识完成下列问题:
(1) 根据上表给出的数据,可推知元素的电负性具有的变化规律
是:
(2)预测Br与I元素电负性的大小关系 ,电负性最小的元素在周期表中的位置是 (放射性元素除外)。
查看答案和解析>>
科目: 来源: 题型:
在下列各元素组中,除一种元素外,其它都可以按某种共性归属一类,请选出各组的例外的元素,并将该组其它元素可能的归属,按所给的6种类型的编号填表
| 元素组 | 例外元素 | 其它元素所属的类型编号 |
| (1)S、N、Na、Mg | ||
| (2)P、Sb、Sn、As | ||
| (3)Rb、B、Te、Fe |
归属类型:①主族元素 ②过渡元素③同周期元素④同族元素⑤金属元素⑥非金属元素
查看答案和解析>>
科目: 来源: 题型:
氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )。
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g的35Cl2气体的体积为1.12L
D.35Cl2气体的摩尔质量为70
查看答案和解析>>
科目: 来源: 题型:
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y的原子序数相差7,下列有关判断错误的是( )
A.X和Y可能处于同一周期
B.X和Y可能处于相邻周期
C.X和Y可能处于同一主族
D.X和Y可能处于相邻主族
查看答案和解析>>
科目: 来源: 题型:
根据原子结构理论和元素周期律,关于114号元素114X(此元素尚未命名,暂以X代替其元素符号)下列说法正确的是( )
A.该元素原子核外有6个电子层
B.该元素原子最外层电子数为4
C.该元素为非金属元素
D.其最高价氧化物对应水化物的化学式为H3XO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com