
科目: 来源: 题型:

(1)写出下列物质的结构简式:A____________,D____________。
(2)指出反应类型:①____________,②____________。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式:____________________。
(4)写出E→F转化的化学方程式:______________________________________________。
(5)上述转化关系中步骤③和④的顺序能否颠倒?____________(填“能”或“不能”),说明理由:_____________________________________________________________________。
(6)PMLA具有良好的生物相容性,可望作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式为________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
【方法一】在氧充足条件下,通过好氧硝化菌的作用,将废水中氨态氮转化为中间过渡形态的硝酸态氮和亚硝酸态氮,然后在缺氧条件下,利用反硝化菌,硝酸态氮和亚硝酸态氮被水中的有机物还原为氮气。见图中之①。反应过程为如下(注:有机物以甲醇表示;当废水中有机物不足时,需另外投加有机碳源)。
2![]() +3O2
+3O2![]() 2HNO2+2H2O+2H+
2HNO2+2H2O+2H+
2HNO2+O2![]() 2HNO3
2HNO3
6![]() +2CH3OH
+2CH3OH![]() 6
6![]() +2CO2+4H2O
+2CO2+4H2O
6![]() +3CH3OH
+3CH3OH![]() 3N2+3CO2+3H2O+6OH-
3N2+3CO2+3H2O+6OH-
【方法二】与方法一相比,差异仅为硝化过程的中间过渡形态只有亚硝酸态氮。见图中之②。

请回答以下问题:
(1)![]() 的空间构型为__________。大气中的氮氧化物的危害有________和________等。
的空间构型为__________。大气中的氮氧化物的危害有________和________等。
(2)方法一中氨态氮元素
(3)从原料消耗的角度说明方法二比方法一有优势的原因:_________________________。
(4)自然界中也存在反硝化作用,使硝酸盐还原成氮气,从而降低了土壤中氮素营养的含量,对农业生产不利,农业上可通过松土作业,以防止反硝化作用。其原因是______________。
(5)荷兰Delft大学Kluyver生物技术实验室试验确认了一种新途径。在厌氧条件下,以亚硝酸盐作为氧化剂,在自养菌作用下将氨态氮(氨态氮以![]() 表示)氧化为氮气(见图中过程③)。其反应离子方程式为___________________________________________________。
表示)氧化为氮气(见图中过程③)。其反应离子方程式为___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
![]()
(1)该过程的化学反应方程式为_________________。
(2)人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式(请将①补充完整):
①![]() Cu2S+
Cu2S+![]() Fe3++
Fe3++![]() H2O
H2O![]()
![]() Cu2++
Cu2++![]() Fe2++
Fe2++![]() ( )+
( )+![]()
![]()
②_______________________________________________________________。
(3)工业上可利用粗铜(含Zn、Ag、Au杂质)经电解制得精铜(电解铜)。则阳极和阴极材料分别为__________和___________,阳极的电极反应式为___________,____________。
(4)请评价细菌冶金的优点___________。(说一点即可)
查看答案和解析>>
科目: 来源: 题型:阅读理解

图Ⅰ
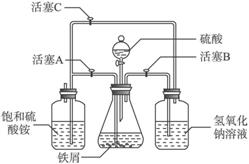
图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是___________,集气瓶的作用是______________;烧杯中主要发生:①CuSO4+H2S![]() CuS↓+H2SO4
CuS↓+H2SO4
②4CuSO4+PH3+4H2O![]() H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0—
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,可制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级—Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制_________过量为最佳。
查看答案和解析>>
科目: 来源: 题型:
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为___________________________,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为_____________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
则操作①的名称为___________,试剂A的化学式为___________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是__________(填化学式),则产生该白色沉淀的离子方程式是______________________。
查看答案和解析>>
科目: 来源: 题型:
A.a mol B.
查看答案和解析>>
科目: 来源: 题型:
A
B
C.同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D.同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3%
查看答案和解析>>
科目: 来源: 题型:

A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e-![]() H2↑
H2↑
C.diluted和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
查看答案和解析>>
科目: 来源: 题型:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(![]() )+
)+![]() )
)
查看答案和解析>>
科目: 来源: 题型:
A.NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++2OH-+2H++![]()
![]() BaSO4↓+2H2O
BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
C.高锰酸钾与乙醇制备Mn3O4纳米粉末,同时生成乙醛:6![]() +13CH3CH2OH
+13CH3CH2OH ![]() 2Mn3O4+13CH3CHO+6OH-+10H2O
2Mn3O4+13CH3CHO+6OH-+10H2O
D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com