
科目: 来源: 题型:

(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
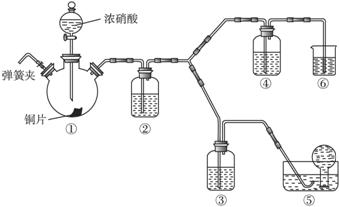
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH====NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是___________,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察绿色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验![]() 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验![]() 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
科目: 来源: 题型:
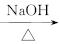
已知酯与醇可发生如下酯交换反应:
RCOOR′+R″OH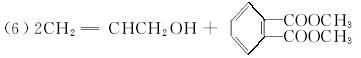 RCOOR″+R′OH (R、R′、R″代表烃基)
RCOOR″+R′OH (R、R′、R″代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是___________________________,
A含有的官能团名称是____________________;
②由丙烯生成A的反应类型是____________________。
(2)A水解可得到D,该水解反应的化学方程式是______________________。
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是________________________。
(4)下列说法正确的是(选填序号字母)___________。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是___________。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是___________。
查看答案和解析>>
科目: 来源: 题型:
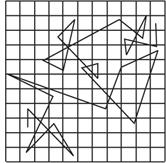
A.分子无规则运动的情况
B.某个微粒做布朗运动的轨迹
C.某个微粒做布朗运动的速度—时间图线
D.按等时间间隔依次记录的某个运动微粒位置的连线
查看答案和解析>>
科目: 来源: 题型:

A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+![]() ====H2O+
====H2O+![]() ,则E一定能还原Fe2O3
,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是![]()
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目: 来源: 题型:
下列各项排序正确的是( )
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
查看答案和解析>>
科目: 来源: 题型:
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com