
科目: 来源: 题型:
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,下列说法中正确的是:
①(a)甲>乙;②(a)甲<乙 ;③(b)甲>乙;④(b)甲<乙
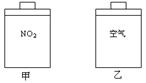
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目: 来源: 题型:
对下列事实的解释正确的是( )
A.浓硝酸的光照下变黄,说明浓硝酸不稳定,且产物有红棕色气体可溶于浓硝酸。
B.向某溶液中加入氯化钡溶液和稀硝酸,有白色沉淀生成,说明该溶液中一定含有![]() 。
。
C.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷、浓硫酸中钝化。
D.氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气与淀粉反应。
查看答案和解析>>
科目: 来源: 题型:
已知在101KPa,298K条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+ 1/2O2 ;△H(298K) = -242kJ·mol-1
B.H2(g)+ 1/2O2(g)= H2O(l);△H(298K) = +484kJ·mol-1
C.H2(g)+ 1/2O2(g)= H2O(g);△H(298K) = -242kJ·mol-1
D.H2(g)+ 1/2O2(g)= H2O(g);△H(298K) = -484kJ
查看答案和解析>>
科目: 来源: 题型:
氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
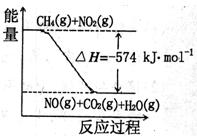
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=—574kJ·mol-1②CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=—1160kJ·mol-1
根据①和②,标准状况下,4.48LCH4恰好将NO2转化为N2时,△H= 。
关于①和②,下列说法正确的是 (填字母)。
a. 由于反应①可推知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<—574kJmol
b. 等物质的量的甲烷分别发生反应①、②,
转移电子数相同
c. 右图可表示①的反应过程和能量关系
(4)同温同压下,3.5LNH3恰好将3.0L NO和NO2的混合气完全转化为N2,原混和气中NO和NO2的体积比是 ![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。① ② ③ 。
查看答案和解析>>
科目: 来源: 题型:
反应![]() 的能量变化如右图所示。下列说法正确的是
的能量变化如右图所示。下列说法正确的是
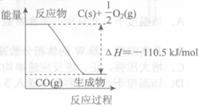
A.12 g C(s)与一定量![]() (g)反应生成14 g CO(g),放出的热量为110.5 kJ
(g)反应生成14 g CO(g),放出的热量为110.5 kJ
B.2 mol C(s)与足量![]() (g)反应生成
(g)反应生成![]() (g),放出的热量大于221 kJ
(g),放出的热量大于221 kJ
C.该反应的热化学方程式是![]()
![]()
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与![]() 分子中化学键断裂时所吸收的总能量的差
分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目: 来源: 题型:
某混合溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现分别取三份溶液进行如下实验:
①第一份加入AgNO3溶液有白色沉淀产生
②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体
③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解。根据上述实验,对原溶液的推测不正确的是
A.一定含有Cl- B.一定不含Ba2+ C.可能含有K+ D.一定含有CO32-和SO42-
查看答案和解析>>
科目: 来源: 题型:
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则下列热化学方程式中正确的是![]()
A.2CH4(g)+4O2 (g)=2CO2(g)+4H2O(L);△H=+890KJ·mol-1![]()
B.CH4(g)+2O2 (g)=CO2(g)+ 2H2O(L);△H=+890KJ·mol-1![]()
C.CH4(g)+2O2 (g)= CO2(g)+ 2H2O(L); △H=-890KJ·mol-1![]()
D.![]() CH4(g)+O2 (g)=
CH4(g)+O2 (g)= ![]() CO2(g)+ H2O(L) ;△H=-890KJ·mol-1
CO2(g)+ H2O(L) ;△H=-890KJ·mol-1![]()
查看答案和解析>>
科目: 来源: 题型:
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O
+O2+4OH-=Fe3O4+S4O![]() +2H2O,下列说法正确的是 ( )
+2H2O,下列说法正确的是 ( )
A.O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.每生成1mol Fe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的最之比为1:1
D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是 ( )
①3Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A.①② B.②③ C.①③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com