
科目: 来源: 题型:
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2=N2+2H2O。下列关于该燃料电池工作时的说法正确的是( )
A.负极的电极反应式是:N2H4+4OH-→4H2O+N2↑+4e-
B.正极的电极反应式是:O2+4H++4e-→2H2O
C.溶液中阴离子向正极移动
D.电解后电解质溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )。
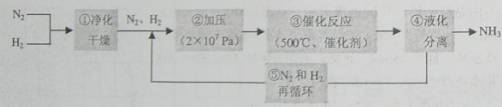
A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
科目: 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的最高价氧化物对应水化物的碱性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同周期元素中Y的气态氢化物稳定性最强
D、三中元素一定属于短周期元素
查看答案和解析>>
科目: 来源: 题型:
在25°C下,将,amol·L-1的醋酸(HAc)与0.01mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(Ac-)。则下列说法中,不正确的是 ( )
A.此时醋酸和氢氧化钠溶液恰好中和
B.反应后混合液的导电性一定弱于0.01mol·L-1的氢氧化钠溶液
C.溶液中的离子浓度大小的顺序为c(Na+)=c(Ac-)>c(OH-)= c(H+)
D.a肯定大于0.01
查看答案和解析>>
科目: 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
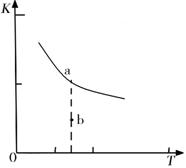
(1)某温度下,2SO2(g)+ O2(g)![]() 2SO3(g);△H= mkJ·mol-1
2SO3(g);△H= mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
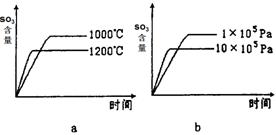
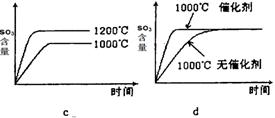
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O![]() NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,![]() 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
查看答案和解析>>
科目: 来源: 题型:
在KClO3+6HCl=KCl+3Cl2+3H2O反应中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为( )
A.6:1 B.5:1  C.1:3 D.1:5
C.1:3 D.1:5
查看答案和解析>>
科目: 来源: 题型:
丙二醇和其他无机原料合成环状化合物D。
(1)请在下列方框内填入合适的化合物的结构简式:
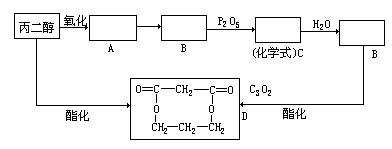
(2)C和水发生加成反应生成B的化学方程式;
(3)D和NaOH水溶液共热的化学方程式;
(4)C属于______类化合物,名称为______。
查看答案和解析>>
科目: 来源: 题型:
某醇CH3CH2CH(CH3)CH(CH3)OH的命名为 ( )
A.1-甲基-2-乙基-1-丙醇 B.3-甲基-2-戊醇
C.1,2-二甲基-1-丁醇 D.3,4-二甲基-4-丁醇
查看答案和解析>>
科目: 来源: 题型:
下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是 ( )
A.FeCl2、FeCl3 B.NaHCO3、Na2CO3
C.NaAl(OH)4、AlCl3 D.Mg(HCO3)2、MgCl2
查看答案和解析>>
科目: 来源: 题型:
元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的溶解度(mmol·L-1)如图。
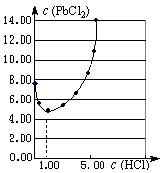
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用 。
a.蒸馏水 b.1mol·L-1盐酸
c.5 mol·L-1盐酸 d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,PbCl2 的溶解度减小,其原因是 。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为:C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为 。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产
物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式 。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com