
科目: 来源: 题型:
现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
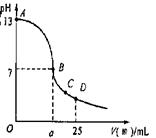
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序 。
查看答案和解析>>
科目: 来源: 题型:
从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液的氧化性,催熟水果
D.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
查看答案和解析>>
科目: 来源: 题型:
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置。请回答下列问题:

(1)g元素在周期表中的位置 。元素a和w形成的化合物wa3是 分子(填”极性”或”非极性”)。
(2)d的氢化物的沸点比h的氢化物的沸点 ,(填”高”、”低”或”相等”)原因是 。
(3)用电子式表示化合物eh的形成过程 。
(4)b和w可形成一种原子晶体,它的用途有 ,(答一种即可)由化合物b(wa2)4在高温下分解可生成wa,和该原子晶体。则该原子晶体的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
位于短周期的四种主族元素A.B.C.D原子序数依次增大,已知A.C位于同一主族,A在周期表中原子半径最小。B.D的最外层电子数相等,且B.D的原子序数之和为A.C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式:
, , , 。
(2)C与D形成D的最低价化合物的电子式:
(3)仅由B.C.D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
查看答案和解析>>
科目: 来源: 题型:
取0.1 mol某烃M在足量的氧气中完全燃烧,生成的CO2气体在标准状况下体积为13.44L,生成的H2O与CO2的物质的量之比为1:1,则:
(1)烃M的化学式为 ;
(2)若烃M能使溴水或高锰酸钾溶液褪色,在一定条件下与H2加成生成2,2-二甲基丁烷,则烃M的结构简式为 ;M与HCl加成的产物有 种;
查看答案和解析>>
科目: 来源: 题型:
下图虚线框中的装置可用来检验浓H2SO4与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:

(1)试剂H是 。
(2)装置②必须位于①之后,其理由是
;必须位于③之前,其理由是 。
(3)当出现 现象时可确认水蒸气的存在,当出现
现象时可确认SO2的存在。
(4)SO2 (填“能”或“不能”)直接排入空气中;(若能,下两问则不用回答)那么本实验装置中G后有接尾气处理装置的必要吗?为什么?
答:① ,② 。
(5)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________。
(6)有同学认为本实验中有一种物质是不能检出的,据你估计他的理由是什么?
。
查看答案和解析>>
科目: 来源: 题型:
14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+01n→14C+11H,下列说法正确的是( )
A.14C和14N互为同位素
B.地球上活着的生物体内,由于新陈代谢作用也存在14C
C.14CO2的摩尔质量为46 D.14C和C60是同素异形体
查看答案和解析>>
科目: 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
查看答案和解析>>
科目: 来源: 题型:
在实验室堕可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
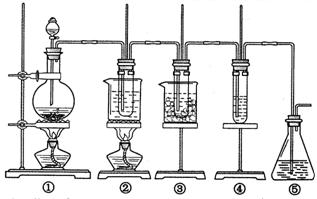
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰.通过_______________________(坡写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)

(3)本实验中制取次氯酸钠的离子方程式是:
___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com