
科目: 来源: 题型:
研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
①向装置图所示的U形管和大烧杯中加入冷水;②在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;③向装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;④将冷却至室温的混合液转移到圆底烧瓶中,加热;⑥制取溴乙烷。同答下列问题:
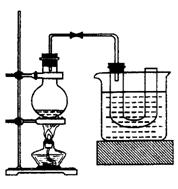
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:
(2)步骤④加热片刻后,烧瓶内的混合物出现橘红色,出现这种现象的原因是(请用化学反应方程式表示) 改用小火加热后,橘红色会逐渐消失,消失的原因是(请用化学反应方程式表示)
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是
。
(4)步骤⑤反应结束后,将U形管中的混合物用 方法得到粗产品。除去粗产品中的杂质,可用下列试剂中的____ ,
A.氢氧化钠稀溶液 B.碳酸钠稀溶液
C.硝酸银溶液 D.四氯化碳
探究二:溴乙烷与NaOH乙醇溶液的反应。学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体。
| 所用试剂操作方法 | 实验现象 | |
| 1 | ||
| 2 |
查看答案和解析>>
科目: 来源: 题型:
25 ℃时,水的电离达到平衡:H2O ![]() H+ + OH- ΔH > 0 ,下列叙述正确的是
H+ + OH- ΔH > 0 ,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
将0.05mol/l的盐酸和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得溶液pH值为12,用上述氢氧化钠溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时,消耗氢氧化钠溶液12.5ml,试求:
(1)氢氧化钠溶液的物质的量浓度?
(2)此一元弱酸的物质的量浓度?
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是 ( )
A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+3NO2=2NO3-+NO↑+H2O
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合
![]()
C.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
D.苯酚与碳酸钠溶液的反应:![]()
查看答案和解析>>
科目: 来源: 题型:
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体,与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1mol氮氮叁键吸收941kJ热量,则
A.N4的熔点比P4高 B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同系物 D.1molN4气体转化为N2时要放出724kJ能量
查看答案和解析>>
科目: 来源: 题型:
锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学反应方程式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3后要清洗漏斗中的Li2CO3,如何检验漏斗中的Li2CO3已经被清洗干净?请你简述实验作: 。
(4)若第④步反应中将Na2CO3改为K2CO3,,则18.1g.废旧锂离子电池正极材料(LiMn2O4相对分子量为181)经反应③和④完全为Li2CO3,至少需要 克K2CO3(相对分子量为138)。
查看答案和解析>>
科目: 来源: 题型:
设 ![]() 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.28g C2H4中含有4![]() 个C-H键
个C-H键
B.1mol.![]()
![]() 溶液含有
溶液含有![]() 个
个![]()
C.1mol Cu和足量稀硝酸反应产生 ![]() 个NO分子
个NO分子
D.常温常压下,22.4L![]() 中含有
中含有 ![]() 个
个![]() 分子
分子
查看答案和解析>>
科目: 来源: 题型:
将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是
A.浅紫色 B.黄色 C.红色 D.无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com