
科目: 来源: 题型:
8.7gMnO2与100mL12mol/L的盐酸混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。试求:
(1)产生的气体在标准状况下的体积;
(2)产生沉淀的质量。
查看答案和解析>>
科目: 来源: 题型:
乙烷受热分别生成乙烯和氢气,现有乙烷部分分解的产物,取产物1.2L使其充分燃烧生成1.6L的二氧化碳(在相同条件下测定),则乙烷的分解率是:
A、20% B、25% C、50% D、75%
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是

A. 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B. 12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4,结构如上图)含有NA个S—S键
查看答案和解析>>
科目: 来源: 题型:
A.B.C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
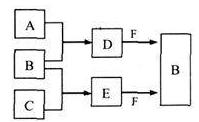
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌.净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热△H= -726.5kJ·mol-1,氢气的燃烧热△H= -285.8kJ·mol-1)
查看答案和解析>>
科目: 来源: 题型:
元素A的阳离子aAm+与元素B的阴离子bBn—具有相同的电子层结构。以下关于A.B元素性质的比较中,正确的是 ( )
①原子序数:a>b ②离子半径:aAm+ <bBn— ③原子半径:A<B ④元素所在的周期数:A>B ⑤A的最高正价与B的最低负价的绝对值相等 ⑥b = a+m-n
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
恒温恒容的情况下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A.容器内气体的密度不随时间而变化
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式书写正确的是( )
A.C(s) + O2(g) == CO2(g) △H= +393.5kJ/mol
B.2SO2 + O2 == 2SO3 △H=-196.6kJ/mol
C.H2(g) + 1/2O2(g) == H2O(l) △H=-285.8kJ/mol
D.2H2(g) + O2(g) == 2H2O(l) △H=-571.6KJ
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是:
A. 32gO2所含的原子数目为NA B. 1 mol CO2 的质量为44g/mol
C. 44g CO2的体积为22.4L D. NA个CO2的质量与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目: 来源: 题型:
实验室要配制100mL、10mol·L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体 g。
(2)配制溶液时一般可分为以下几个步骤: ①称量 ②计算 ③定容
④移液 ⑤洗涤 ⑥溶解 其正确的操作顺序为 。
(3)(2分,每空1分)该实验两次用到玻璃棒,其作用分别是:
① 溶解时玻璃棒的作用 ② 移液时玻璃棒的作用
(4)容量瓶上需标有以下5项中的 ①温度 ②浓度 ③容量 ④压强 ⑤刻度线( )
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
(5)若用NaCl固体配制溶液,下列仪器中,不需要用到的是_____ 。(填序号)
A.蒸发皿 B.100mL容量瓶 C.烧杯 D.胶头滴管 E.药匙 F.托盘天平 G.玻璃棒
(6)下列错误操作会导致所得溶液浓度偏低的是 (多项,填序号)。
A. 定容时仰视容量瓶刻度线
B. 容量瓶中原有少量蒸馏水
C. 定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
D. 配制好溶液后,容量瓶未塞好,洒出一些溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com