
科目: 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
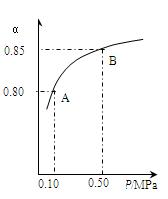
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____ 。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示)。放出的热量为______ kJ。
(3)新型纳米材料氧缺位铁酸盐
(MFe2Ox 3<x<4,M为Mn、Co、Zn或Ni),是由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
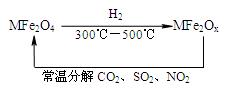
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
查看答案和解析>>
科目: 来源: 题型:
在下列的平衡系中,所用措施,不能使反应向右移动达到新平衡的是( )
A. I-3(aq) ![]() I2 + I-(aq)(加入四氯化碳)
I2 + I-(aq)(加入四氯化碳)
B.Ag+(aq)+ Cl-(aq)![]() AgCl(s)(加入固体AgNO3)
AgCl(s)(加入固体AgNO3)
C.Fe(SCN)2+(aq) ![]() Fe3+(aq) + SCN-(aq)(加入固体NaSCN)
Fe3+(aq) + SCN-(aq)(加入固体NaSCN)
D.BaSO4(s) ![]() Ba2+(aq)+ SO42-(aq)(加入水)
Ba2+(aq)+ SO42-(aq)(加入水)
查看答案和解析>>
科目: 来源: 题型:
关于Al的叙述中,正确的是
A.Al的摩尔质量是27 g B.1mol Al中所含原子数约为6.02×1023
C.1 mol Al的质量是27 g / mol D.常温常压下,1 mol Al的体积为22.4 L
查看答案和解析>>
科目: 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- → 34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
查看答案和解析>>
科目: 来源: 题型:
已知反应:CO (g) + H2O(g)![]() CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号)
A. 22.2% B.27.55% C.33.3% D.36.8%
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比较,则下列说法中正确的是 (填序号)
①生成物的产量一定增加 ②反应物的浓度一定降低
③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低
查看答案和解析>>
科目: 来源: 题型:
有关①100ml 0.1 mol/L ![]() 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L ![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目: 来源: 题型:
根据化学原理得出有关判断,其中正确的是
A.由于水分子间存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C.若弱酸HA的酸性强于弱酸HB,则同温度、同浓度钠盐溶液的碱性:NaA<NaB
D.一定条件下,氯酸钾与碘发生反应2KClO3+ I2=2KIO3+Cl2,则氧化性:I2>Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com