
科目: 来源: 题型:
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 、 |
查看答案和解析>>
科目: 来源: 题型:
高血脂症是现代人的健康杀手之一,科学家最新研制的一种可用于治疗高血脂的新药H可按如下路线合成。

信息2:两个羟基同时连在同一个碳原子上的结构是不稳定的,会发生脱水反应:

根据以上图示和信息,回答下列问题:
(1)反应①—⑤中属于取代反应有 (填写反应的编号),B中官能团的名称为
。
(2)完全燃烧时,1mol D与1mol下列 的耗氧量相同(填写字母的代号)。
a. C6H6 b. C7H8O3 c. C6H10O2 d. C7H8O
(3)G的分子式为C10H22O3,写出E、F结构简式:
E F
(4)写出与I互为同分异构体,且既含有苯环又能发生银镜反应的物质的结构简式
、 、 、
(5)写出F与新制氢氧化铜悬浊液反应的化学方程式:
(6)写出H与NaOH溶液共热的化学方程式
查看答案和解析>>
科目: 来源: 题型:
一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:
X(g)+3Y(g)![]() 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为1/8mol/(L·S)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的1/5
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0 ,升高温度,平衡常数K减小。
查看答案和解析>>
科目: 来源: 题型:
2010年上海世博会是一次清洁能源技术的集中展示,其一是世博会的主要建筑都安装了太阳能光伏发电系统,系统引进了最先进的太阳能半导体薄膜,储藏阳光并转化为电能。下列叙述不正确的是
A.符合低碳、绿色、科技的世博理念
B.光伏发电系统是化学能转变为电能的装置
C.这种半导体材料主要是硅
D.核能、水力、风力、生物能(沼气)、海潮能等都是清洁能源
查看答案和解析>>
科目: 来源: 题型:
反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是 ( )
A低温下自发进行,高温下非自发进行
B高温下自发进行,低温下非自发进行
C任何温度下均为非自发进行
D任何温度下均为自发进行
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是
A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+====Ca2++2H2O
B.用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++![]() +2OH-====CaCO3↓+
+2OH-====CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要量取98%密度为1.84g/cm3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶
⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用是 。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,吸出水使液面恰好到刻度线。 。
③容量瓶清洗完后没有干燥。
查看答案和解析>>
科目: 来源: 题型:
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目: 来源: 题型:
铜在自然界主要以硫化物(CuFeS2等)或氧化物(Cu2O等)的形式存在,其冶炼方法依矿石的性质而有所不同。
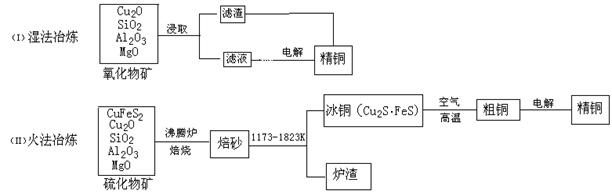
(1)已知Cu2O在酸性条件下易歧化,写出Cu2O与稀硫酸反应的离子方程式: ;
(2)工业上常用具有酸性的2-羟基-5-十二烷基甲酮肟(用HR代表)来浸取氧化物矿,反应可简单表示为:Cu2++2HR![]() CuR2+2H+,浸取过程中要控制适宜的酸度,简述pH过大或过小的后果分别是 , 。
CuR2+2H+,浸取过程中要控制适宜的酸度,简述pH过大或过小的后果分别是 , 。
(3)在沸腾炉中发生的反应为:2CuFeS2+O2![]() Cu2S+2FeS+SO2↑,在该反应中还原产物为 ,每生成1mol Cu2S,转移电子 mol
Cu2S+2FeS+SO2↑,在该反应中还原产物为 ,每生成1mol Cu2S,转移电子 mol
(4)湿法冶炼(I)比火法冶炼(II)更有优势,请说出两条理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com