
科目: 来源: 题型:
某经常刮大风的海岛上生活着一群昆虫,经调查翅的长度和个体数的关系如右图中曲线(纵坐标为翅的长度,横坐标为个体数量)。
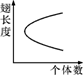
下列叙述错误的是
A.该昆虫的性状分歧是自然选择的结果
B.上述现象说明自然选择在一定程度上是不定向的
C.在生存斗争中,生物和无机环境之间进行着相互选择
D.自然选择对不同种群的基因频率的改变所起的作用有所差
别,最终导致这些种群的基因库变得很不相同,并逐步出现生殖隔离
查看答案和解析>>
科目: 来源: 题型:
下列关于化合物的叙述,正确的是
A.纤维素是植物细胞壁的主要成分,它的基本组成单位是葡萄糖
B.动物细胞间质的物质中主要成分是蛋白质,可用胃蛋白酶处理动物组织
C.DNA是生物的主要遗传物质,它的组成元素有C、H、O、N,部分含S、P
D.磷脂是细胞膜的主要成分,也是线粒体、中心体、叶绿体等生物膜的主要成分
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是
A.1mol甲烷的质量与甲烷的摩尔质量相等
B.28g氮气与40g氩气所含的原子数目相等,都是NA个
C.2.3g钠由原子变成离子,失去的电子数为0.1NA
D.18g重水(D2O)所含的电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
如今人们把食品分为绿色食品、蓝色食品、白色食品等类型。绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。下面属于白色食品的是
A.食醋 B.面粉 C.海带 D.食盐
查看答案和解析>>
科目: 来源: 题型:
(1) 某温度(t℃)时,水的Kw=10-13 ,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b ;
②若所得混合液的pH=2,则a∶b ;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值__ _7,混和前c(NH3·H2O)_ _ c(HCl),氨水中c(OH- ) _盐酸中c(H+)。(填>、<或=,下同)
查看答案和解析>>
科目: 来源: 题型:
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
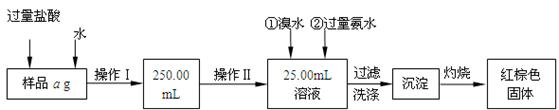
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 ,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量
分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不在用盐酸,为什么
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目: 来源: 题型:
36.5gHCl溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度:c=1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5gHCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
查看答案和解析>>
科目: 来源: 题型:
用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如下图,则下列说法不正确的是

A.阴极区电极反应式为:2H++2e-=H2↑
B.该过程中的副产品主要为H2SO4溶液
C.阳极室内HSO3-.SO32-被氧化为SO42-
D.10L 2mol/L NaOH溶液最多吸收标准状况下224L SO2
查看答案和解析>>
科目: 来源: 题型:
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
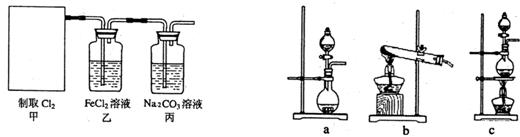
①在该实验中,甲部分的装置是 (填字母);
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸则丙中反应的化学方程式是
④该实验存在明显的缺陷改进的方法是
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
已知存在如下反应:(以下方程式均未配平)
![]()
其中A和C 为常见的金属单质;B和D为氧化物且B具有磁性;E为无色气体单质,据此回答:
(1)物质E是
(2)写出A与氢氧化钠溶液反应的离子方程式:
(3)若将B溶于盐酸中可形成溶液F,F中存在的两种金属阳离子是 ,
(填离子符号)
现有如下两种检验F中的低价金属阳离子的实验方案(包括实验步骤及预设实验现象):
分别取少量F溶液于两支洁净的试管中
方案1:向第一支试管中滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红色
方案2:向第二支试管中滴加酸性KMnO4溶液振荡,KMnO4溶液的紫色退去
上述两种方案中合理的是 (填方案1或方案2)
若有不合理的请说明理由(若均合理此空可以不填)
(4)若向溶液F中加入少量铜粉,振荡后,铜粉逐渐溶解,请写出此过程中发生的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com