
科目: 来源: 题型:
下列对甲烷和乙烯的描述正确的是
A.乙烯比甲烷的碳的质量分数低 B.燃烧时,乙烯与甲烷现象一样
C.它们都能使溴水褪色 D.充分燃烧时,产物都是二氧化碳和水
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是
A.共价化合物中一定不含离子键,离子化合物中一定不含共价键
B.两种元素组成的化合物中一定不含非极性键
C.离子化合物在溶于水和熔融态时都能导电,有些共价化合物在溶于水时导电,但在液态时不能导电
D.非金属元素组成的化合物,一定是共价化合物
查看答案和解析>>
科目: 来源: 题型:阅读理解
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术
叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
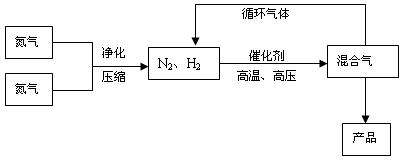
反应体系中各组分的部分性质见下表:
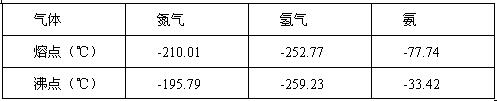
(1)下列说法正确的是
A. 因为△H= -92.4 kJ/mol,所以该反应一定能自发进行
B. 因为△S = -198.3J·mol-1·K-1所以该反应一定不能自发进行
C. 该反应在一定条件下可能自发进行。
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。
(3)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率а1= ,此时反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2 а1(填“>、<或=”)。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g) 反应的影响。
2NH3(g) 反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
① 图像中T2和T1的关系是:T2 T1,(填“高于”“低于”“等于”“无法确定”)
② 比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母)。
③ 在起始体系中加入N2的物质的量为n/3mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(不用写单位)
查看答案和解析>>
科目: 来源: 题型:
下列化学反应中,为使平衡体系析出更多的银,可采取的措施是
Ag++Fe2+ ![]() Ag(固)+Fe3+△H<0
Ag(固)+Fe3+△H<0
A.移去一些析出的银 B.增加Fe3+的浓度 C.增加Fe2+的浓度 D.常温下加压
查看答案和解析>>
科目: 来源: 题型:
. 某有机物的结构为下图所示,这种有机物不可能具有的性质是( )

①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目: 来源: 题型:
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极 ②铝合金是负极www..com
③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④
C.①② D.①④
查看答案和解析>>
科目: 来源: 题型:
向50mL 18mol/L 的H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4 的物质的量
A. 小于0.45mol B. 等于0.45mol
C. 在0.45mol和0.9mol之间 D. 大于0.9 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com