
科目: 来源: 题型:
关于氢键,下列说法不正确的是
A.每一个水分子内含有两个氢键
B.冰、水中都存在氢键
C.水是一种非常稳定的化合物,这由于水分子之间形成氢键无关
D.水的沸点很高,原因之一是水分子间存在氢键
查看答案和解析>>
科目: 来源: 题型:
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:

上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:__________________。
查看答案和解析>>
科目: 来源: 题型:
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 | Al | B | Be | C | Cl[ | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系_____________________________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
如图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是
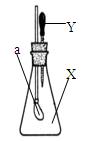
A.X是Cl2,Y是NaOH溶液
B.X是HCl,Y是NaCl的稀溶液
C.X是SO2,Y是NaOH溶液
D.X是CO2,Y是稀硫酸
查看答案和解析>>
科目: 来源: 题型:
在150℃,101 kPa下由CO、H2组成的混合气体共6 g,其相对氢气的密度为7.5,将该气体在充足的氧气中完全燃烧后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为 g,燃烧消耗的氧气在标准状况下的体积应是 L。
查看答案和解析>>
科目: 来源: 题型:
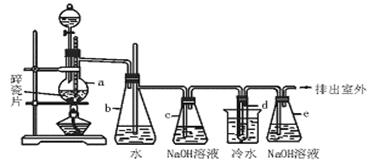
1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于有机溶剂,在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有酒精和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
(1)写出实验中制备1,2—二溴乙烷的两个化学反应方程式 ,
。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(3)容器c中NaOH溶液的作用是__________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、化学计量数a的值为 ;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应);与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com