
科目: 来源: 题型:
某温度下将一定量密度为1.15g/cm3的NaCl溶液用石墨电极直流电,设NaCl恰好完全反应,且无其它反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比;
(2)求原NaCl溶液的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
下列有关工业生产的叙述正确的是 ( )
A.合成氮生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精练铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
科目: 来源: 题型:
下列实验设计和结论相符的是 ( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
查看答案和解析>>
科目: 来源: 题型:
科学家从化肥厂生产的![]() 中检出组成为
中检出组成为![]() 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以![]() 和
和![]() 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收![]() ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)![]() ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、![]() 的空间构型均为四面体,
的空间构型均为四面体,![]() 的结构式为
的结构式为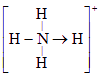 (
(![]() 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为![]()
请画出![]() 的结构式____________________________________;
的结构式____________________________________;
(4)已知液氨中存在着平衡![]() 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的![]() 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
(5)含有一定量![]() 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时:![]()
加碱时:![]()
由于![]() 和
和![]() 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中![]() 与
与![]() 基本保持不变;
基本保持不变;
含有一定量![]() 和
和![]() 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_____________________________________________;
加碱时_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。

Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。

(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
查看答案和解析>>
科目: 来源: 题型:
化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是 ( )
①鸡蛋白溶液遇浓硝酸—黄色 ②淀粉碘化钾溶液遇碘离子—蓝色
③溴化银见光分解—白色 ④热的氧化铜遇乙醇—红色
⑤新制氯水久置后—无色 ⑥过氧化钠在空气中久置—淡黄色
A.①②③⑤ B.①④⑤ C.②③④⑥ D. ④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是 ( )
![]() A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2+ + 2Br- Cu +Br2
A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2+ + 2Br- Cu +Br2
B.Na2S溶液水解:S2— + 2H2O![]() H2S+2OH—
H2S+2OH—
C.Fe(NO3)3的酸性溶液中通入足量硫化氢:
2Fe3++H2S=2Fe2++S↓+2H+
D.H218O中投入Na2O2:
2H218O+2Na2O2=4Na++4OH-+18O2↑
查看答案和解析>>
科目: 来源: 题型:
对于平衡体系2SO2(g)+O2(g)![]() 2SO3(g) △H<0。下列结论中正确的是( )
2SO3(g) △H<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍
B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1
C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率
D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2
查看答案和解析>>
科目: 来源: 题型:
关于下列图示的说法中正确的是A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 ( )
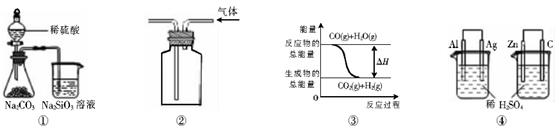
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
查看答案和解析>>
科目: 来源: 题型:
天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为 。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)![]() H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) ![]() ,高脱硫率可采取的措施是 。
,高脱硫率可采取的措施是 。
a.高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g) ![]()
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s)+6S(s) ![]()
则2H2S(g)+O2(g)=2H2O(g)+2S(s) ![]() = (用a、b表示)
= (用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下:
H3S+1.5O2=H2O+SO2 SO2+0.5O2![]() SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)![]() H2SO4(aq)
H2SO4(aq)
该法最终得到的硫酸溶液的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com