
科目: 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.K2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂
B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用
C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道某处泄漏
D.用氯气与乙烷混合光照获得纯净的1,2-二氯乙烷
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=3的1.0LNaHSO3溶液中,含Na+数目为0.001 NA
B.2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA
C.标准状况下,2.24L溴乙烷中含共价键数目为0.7 NA
D.5.6gFe投入100mL 3.5mol/L硝酸中,充分反应,转移电子总数为0.3 NA
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布式为:![]()
B.蔗糖与醋酸的最简式相同
C.纯碱与汽油去除油污的原理相同
D.“84消毒液”中有效成分NaClO的电子式为:![]()
查看答案和解析>>
科目: 来源: 题型:
下列化学用语表示正确的是
A.NaH与重水反应的方程式:NaH+D2O=NaOH +D2↑
B.三氟化氮的电子式:![]()
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.羟基乙酸(HOCH2COOH)的缩聚物:![]()
查看答案和解析>>
科目: 来源: 题型:
每年3月22日是世界水日,联合国确定的2010年“世界水日”主题是“关注水质、抓住机遇、应对挑战”。下列有关说法或做法不符合这一主题的是
A.科学使用农药、化肥,减少水体污染
B.工业废水和城市生活污水需净化处理,坚持达标排放
C.为了节约生产成本,可将造纸厂、化工厂建在水源地上游
D.合理开发水资源,建立水资源节约型和环境友好型经济
查看答案和解析>>
科目: 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有_ _、烧杯、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。

图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ___。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图2装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__ ____。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
 [
[
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
A.请在上表空格中填入剩余的实验条件数据。
 B.根据反应N2+ 3H2
B.根据反应N2+ 3H2![]() 2NH3的特点,在给出的坐标图2中,
2NH3的特点,在给出的坐标图2中,
画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
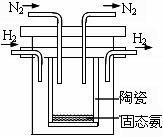
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式 。
查看答案和解析>>
科目: 来源: 题型:
下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

(1)写出有关物质的名称或化学式:F ,H 。
若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(2)写出B与MnO2共热获得D的化学方程式 。
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4mo1/L ,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KⅠ溶液,观察到的现象 ,沉淀能够发生转化的原因是 。
查看答案和解析>>
科目: 来源: 题型:
元素A、B、C是元素周期表中短周期的三种元素,请根据表中信息回答下列问题。
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同。 | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料。 | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D。 |
(1)写出B在元素周期表的位置__________。
(2)C的气态氢化物的电子式__________,检验D中阳离子的实验方法是______________。
(3)D的水溶液呈_________(填“酸性”、“碱性”或“中性”),其原因用离子方程式表示为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com