
科目: 来源: 题型:
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol,设E为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
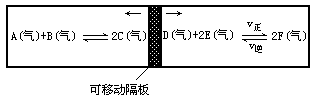
(1)若x=4.5,则右侧反应在起始时向______(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______(填“相等”、“不相等”或“不能确定”)。其理由是______。
查看答案和解析>>
科目: 来源: 题型:
下图中①~ ![]() 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
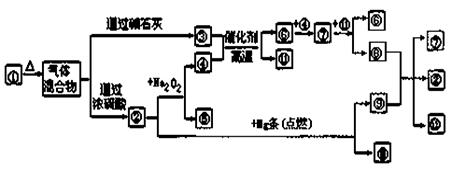
(1)①、③、④的化学式分别是______、______、______。
(2)⑧与⑨反应的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:
2CrO![]() (黄色)+2H+
(黄色)+2H+![]() Cr2O
Cr2O![]() (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
b.2v(Cr2O![]() )=v(CrO
)=v(CrO![]() )
)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O![]() 离子,需要________mol的FeSO4·7H2O。
离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用Fe做电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________________________________________
________________________________________________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目: 来源: 题型:
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用如图K16-2所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。

图K16-2
(1)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是________________________________________。
A.200 mL B.400 mL C.500 mL
(2)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重1.28 g,则圆底烧瓶中发生反应的化学方程式为______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到V mL气体,则有:a g÷65 g·mol-1=b g÷64 g·mol-1+V mL/22400 mL·mol-1,依据的原理是___________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)/n(SO2)=______________________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U形管,n(H2)/n(SO2)的数值将________(填“偏大”“偏小”或“无影响”)。
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①________________________________________________________;
②________________________________________________________;
③____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A. -1780 kJ/mol B. -1220 kJ/mol
C.-450 kJ/mol D. +430 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C. 电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com