
科目: 来源: 题型:
(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为 ;
②若V=35,试计算混合物中CuS的质量分数。
查看答案和解析>>
科目: 来源: 题型:
(12分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下(图中BC—1、BC—2均为稳定剂):
2Na2CO3 + 3H2O2 → 2 Na2CO3·3H2O2 △H<0
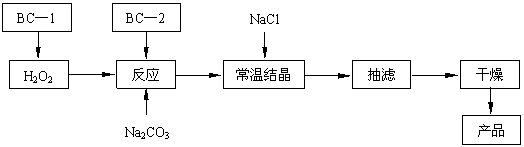 |
回答下列问题:
⑴过碳酸钠用作消毒剂时,其消毒机理与下列 (填写序号) 物质相似。
A.75%酒精 B.苯酚 C. KMnO4稀溶液 D.84 消毒液(NaClO溶液)
⑵结晶过程中加入氯化钠搅拌的作用是 。
⑶加入BC—2稳定剂与工业纯碱中含有的Fe3+杂质生成稳定的配合物的目的是 。
⑷由实验测定反应温度对产物的影响如下表:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
⑸以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
⑹过碳酸钠极易分解,则产生6.72LO2(标况)需过碳酸钠 g。
查看答案和解析>>
科目: 来源: 题型:
(10分)实验室常用的几种气体发生装置如图A、B、C所示:
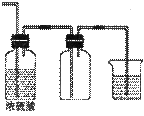
A B C D
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是 (填序号,下同。)①密度 ②颜色 ③溶解性 ④热稳定性
下图是某学生设计收集气体的几种装置,其中不可行的是 。

(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______,
①CO2 ② NO ③ Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________。
查看答案和解析>>
科目: 来源: 题型:
(12分)复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺流程示意图:

已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,
检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是 ;
(4)生产中可获得的副产品是 ,已知提取该副产品有以下5个步骤,请排出正确的操作顺序是 (用序号表示)。
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
查看答案和解析>>
科目: 来源: 题型:
下图为工业制备硝酸的设备示意图,其生产过程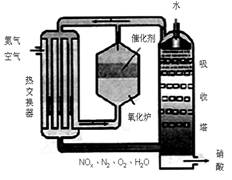 中发生的反应主要有:
中发生的反应主要有:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2 (g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l)![]() 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
查看答案和解析>>
科目: 来源: 题型:
(10分)我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3。某研究性学习小组设计如下图所示的模拟装置,该装置可实现部分原料的循环使用。
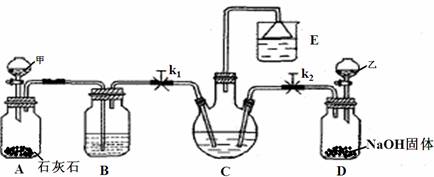 |
(2)实验操作过程中,应先打开 ▲ (填“k1”或“k2”),当观察到 ▲ 现象时,再打开另一个弹簧夹。
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是 ▲ 、 ▲ 。
(4)老师认为在C、D之间还应增加一个装置,该装置作用为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
 (1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(2)控制水浴温度在60~80℃之间的目的是 ▲ ,图示装置中缺少的一种必须的玻璃仪器是 ▲ 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 ▲ 。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量用稀硝酸酸化过的氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
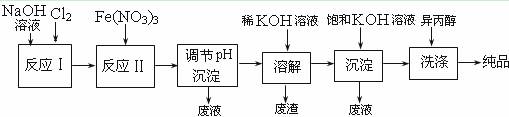
|
①反应I的化学方程式为 ▲ 。
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水
的原理为 ▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与
还原剂的物质的量之比为 ▲ 。
(4)高铁电池是正在研制中的可充电干电池,
右图为该电池和常用的高能碱性电池的
放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
由白色和黑色固体组成的混合物A,可以发生如下框所示的一系列变化:

(1)写出反应①的化学方程式: 。
反应④的离子方程式: 。
(2)下列实验装置中可用于实验室制取气体G的发生装置是 (填序号)。
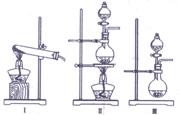
⑶为了得到纯净干燥的气体G,可将气体通入a和b装置,a、b两广口瓶中所装入的溶液依次是a: ,b: 。c、d装置不完整,请在图中补充完整。

⑷气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出d中发生反应的的离子方程式: ;
⑸J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com